
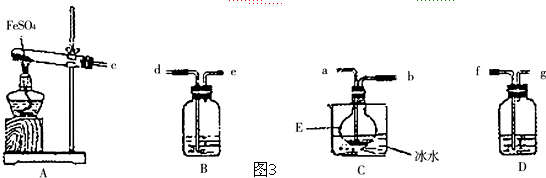
 为测定氨分子中氮、氢原子个数比,某研究性学习小组用浓氨水和氧化钙反应制取氨气,然后用氨气与氧化铜粉末发生氧化还原反应.设计了如下实验流程:实验中,先检查装置气密性;然后用制得的氨气排尽洗气瓶前所有装置中的空气;再连接洗气瓶和气体测量装置;立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
为测定氨分子中氮、氢原子个数比,某研究性学习小组用浓氨水和氧化钙反应制取氨气,然后用氨气与氧化铜粉末发生氧化还原反应.设计了如下实验流程:实验中,先检查装置气密性;然后用制得的氨气排尽洗气瓶前所有装置中的空气;再连接洗气瓶和气体测量装置;立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
| ||
| ||
| 273V |
| 298 |
| 273V |
| 298×22.4 |
| 273V×2 |
| 298×22.4 |
| 2(m2-m1) |
| 18 |
| 273V×2 |
| 298×22.4 |
| 2(m2-m1) |
| 18 |


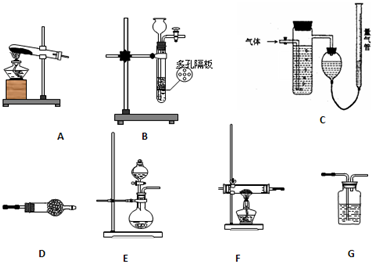
科目:高中化学 来源: 题型:
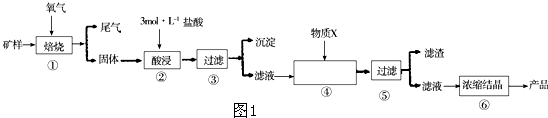
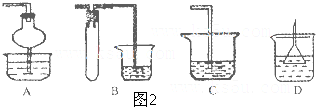
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
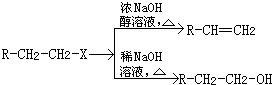
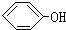 合成
合成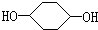 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)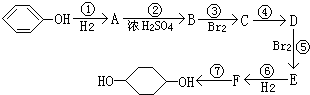
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当容器内混合气体的密度不再发生变化时,反应即达到平衡状态 |
| B、达平衡后若升高温度,该反应的平衡常数将增大 |
| C、平衡时反应物B的转化率为15.0% |
| D、达平衡后,如果此时移走2 molA和1molB,在相同温度下再达平衡时C的浓度<0.3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
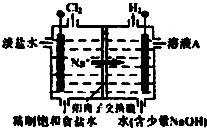 (1)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,该“水”电池在海水中放电时的负极反应式是
(1)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,该“水”电池在海水中放电时的负极反应式是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com