
【题目】采用不同的分类方法,可将非金属氧化物分为不同的类别。根据某种共性,可将CO2、P2O5、SO2、SO3、Cl2O7归为一类,下列物质中,完全符合此共性而能归为此类物质的是( )
A. CaO B. CO C. SiO2 D. H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,发生反应:
PCl5(g)=====PCl3(g)+Cl2(g) △H=akJ/mol(a>0)
0~10min保持容器温度不变,10min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。下列说法正确的是

A. 0~4min的平均速率v(Cl2)=0.05mol/(L·min )
B. 10min时改变的条件是分离出一定量的PCl5
C. 起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,反应达平衡时放出的热量大于1.6akJ
D. 温度为T,起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,反应达到平衡前,v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+ I![]()
![]()
上述平衡体系中,![]() 的物质的量浓度c(
的物质的量浓度c(![]() )与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):
)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):

(1)通过分析上图,该反应的正反应为 反应(填“吸热”或“放热”)。
(2)在T1温度D状态时,v正 v逆(填“>”“<”或“=”);若在T1时某状态![]() =
=![]() , 平衡状态(填“是”“不是”或“不一定是”)。
, 平衡状态(填“是”“不是”或“不一定是”)。
(3)写出该平衡常数的表达式K = 。若升高温度,K值将 (填“增大”或“减小”或“不变”,下同);若向溶液中加入少量的溴水,K值将 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵晶体,塞紧瓶塞。在瓶底和木板间滴少量水(如图所示)。一段时间后,发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板黏结在烧瓶底部。这时打开瓶塞,烧瓶中散发出刺鼻的气味。

(1)下列有关该实验的结论正确的是 (填字母)。
A.自发反应一定是放热反应
B.自发反应一定是吸热反应
C.有的吸热反应也能自发进行
D.吸热反应不能自发进行
(2)发生反应的化学方程式为 。
(3)从化学反应进行方向的角度解释上述现象: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是高中阶段学习的常见单质或化合物,单质A在单质B中燃烧产生苍白色的火焰,产物溶于水得到常见的强酸。化合物C具有强氧化性、漂白性,是单质B与水反应的产物之一。化合物D是淡黄色物质,可用于呼吸面具,可由一种活泼金属E在氧气中燃烧得到。回答问题:
(1)物质C的名称____________ ,化合物D中非金属元素的化合价为___________。
(2)单质A在单质B中燃烧的化学方程式为___________。
(3)单质B与水反应的离子方程式为___________。
(4)化合物D与水反应的离子方程式___________。
(5)活泼金属E与水的反应中,单质E是______(填“氧化剂”或“还原剂”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究化学反应中的能量变化时我们通常做如图所示的实验。
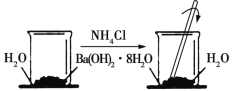
在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先滴有3~4滴水的玻璃片(或三合板)上,然后向烧杯内加入NH4Cl晶体约10 g,并立即用玻璃棒迅速搅拌。
试回答下列问题:
(1)实验中要立即用玻璃棒迅速搅拌的原因是 。
(2)如果实验中没有看到“结冰”现象,可能的原因是 (要求答出三个以上的原因)。
(3)如果实验中没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?
(要求答出两种方案)。
(4)该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. H2SO4+2NaOH==Na2SO4+2H2O
B. 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
C. NH3+HCl==NH4Cl
D. CuO+H2![]() Cu+H2O
Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个简易测量物质反应是吸热还是放热的实验装置。将镁片加入小试管内,然后注入足量的盐酸。

请根据要求回答下列问题:
(1)有关反应的离子方程式是__________________________________。
(2)试管中观察到的现象是__________________________________。
(3)U形管中左端液面 (填“上升”或“下降”),原因是________________________________,说明此反应是______(填“放热”或“吸热”)反应。
(4)由实验推知,MgCl2和H2的总能量____________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g) ![]() 6CO2(g)+6H2O(l) ΔH=2800 kJ mol1
6CO2(g)+6H2O(l) ΔH=2800 kJ mol1
葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算:
(1)100 g葡萄糖在人体内完全氧化时所产生的热量为_______________。
(2)人的体温一般要保持在36.5°C,低于此温度则要“打寒战”,并靠消耗葡萄糖释放出的能量来维持体温,与此同时有一部分能量转化为ATP。若形成 1 mol ATP需消耗10.75 g葡萄糖,则“打寒战”时会有________ %的能量转化成热量。(已知形成1 mol ATP需消耗75.24 kJ的能量)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com