
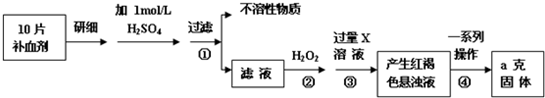
a×
| ||
| 10 |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中通入足量的CO2气体:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、向FeSO4酸性溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O |
| C、向溴水中通入SO2气体:SO2+Br2+2H2O=2H++SO42-+2HBr |
| D、FeS加入稀硫酸中:S2-+2H+=H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知,现使用1 mol/L KI溶液、0.1 mol/L硫酸和淀粉溶液探究溶液出现蓝色的时间与温度的关系,应先将1 mol/L KI溶液、0.1 mol/L硫酸混合,升温后再加入淀粉溶液 |
| B、将稀氯化铁溶液和稀硫氰化钾溶液混合,溶液呈浅红色,无论向其中加入浓氯化铁溶液还是浓硫氰化钾溶液,红色都会加深 |
| C、向0.1 mol/L的醋酸和饱和硼酸溶液中滴加等浓度的碳酸钠溶液,均有气体生成 |
| D、实验测定酸碱滴定曲线时.要保证整个过程测试和记录pH的间隔相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
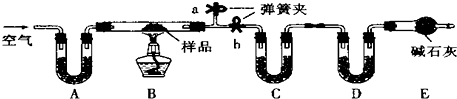
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

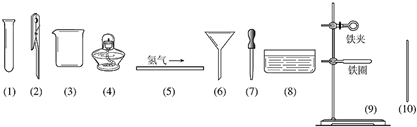
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
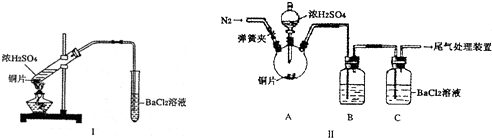
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
| 第一次称量 | 第二次称量 | ||
| 11.710g | 22.700g | 18.621g | a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com