
一定温度下,10 mL 0.4 mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表:
下列叙述错误的是(溶液体积变化忽略不计)( )
A.反应至6 min时,c(H2O2)=0.20mol/L
B.反应至6 min时,H2O2分解了40%
C.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol.L-1.min-l
D.6~10 min的平均反应速率:可(H2O2) <3.3×10-2 mol.L-1.min-l
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江西省高三上学期第一次段考化学卷(解析版) 题型:选择题
一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s)  CaO(s)+CO2(g)达到平衡,下列说法正确的是
CaO(s)+CO2(g)达到平衡,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2,△s<0
C.将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D.保持容器体积不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上学期9月月考化学试卷(解析版) 题型:选择题
用惰性电极电解CuSO4溶液。若阳极上产生气体的物质的量为0.0100 mol,则阴极上析出Cu的质量为( )
A. 1.28 g B.0.64 g C.2.56 g D.5.12 g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷(解析版) 题型:推断题
A、B、C、D、E、F六种短周期主族元素的原子序数依次增大。A是元素周期表中原子半径最小的元素;B元素的原子最外层电子数是次外层电子数的2倍;D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y;D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N;F的最高正化合价为+6。
回答下列问题:
(1)C元素的化学名称为____________,F元素的化学名称为____________。
(2)Y的电子式为____________,M中阴离子的离子符号为___________。
(3)由以上六种元素中的两种原子构成的五核10e-分子的空间构型是______________。
(4)用电子式表示化合物E2F的形成过程为____________________。
(5)D、F的简单氢化物的沸点高低为____________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷(解析版) 题型:选择题
室温下,将1 mol Na2CO3·10H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1 mol Na2 CO3(s)溶于水会使溶液温度升高,热效应为△H2;Na2CO3·10H2O受热分解的化学方程式为Na2CO3·10H2O (s)  Na2CO3(s)+10H2O(1),热效应为△H3。则下列判断正确的是( )
Na2CO3(s)+10H2O(1),热效应为△H3。则下列判断正确的是( )
A.△H2 <△H3 B.△H1>△H3 C.△Hl+△H3=△H2 D.△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次段考化学卷(解析版) 题型:填空题
(1)已知:2Al(s)+O2(g)=Al2O3(s) △H=-1644.3kJ·mol-1
2Fe(s)+O2(g)=Fe2O3(s) △H=-815.88kJ·mol-1
写出铝粉与氧化铁粉末发生铝热反应的热化学方程式 。
(2)高铁酸钾(K2FeO4)在水中的反应为4FeO42-+10H2O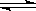 4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。
4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。
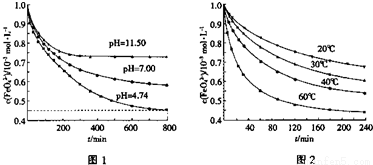
①pH=4.74时,反应从开始到800min时平均反应速率v(OH-)= 。
②图1在800min后,三种溶液中的c(FeO42-)均不再改变。随着pH的变大,此反应的平衡常数K (填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中FeO42-的浓度不再变化,下列说法正确的是
a.上述反应的△H>0 b.升高温度,该反应pH减小
c.温度越高,反应速率越慢 d.加入盐酸,FeO42-的浓度减小
④FeO42-在水溶液中的存在形态如图3所示。下列说法正确的是

A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐变大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O
⑤高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
已知:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是 。
(3)常温常压下,饱和氯水中氯气总浓度约为0.09mol/L,且存在可逆反应:Cl2 + H2O  HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O
HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O HCl+HClO的平衡常数为 。
HCl+HClO的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次段考化学卷(解析版) 题型:选择题
体积相同的盐酸和醋酸两溶液中n(Cl-)=n(CH3COO-)=0.01mol,下列正确的是
A.两种溶液的pH不相同
B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多
C.分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-)
D.它们分别与足量CaCO3反应时,放出的CO2一样多
查看答案和解析>>
科目:高中化学 来源:2016-2017学年北大附中河南分校高二上第一次月考化学卷(解析版) 题型:填空题
白磷和红磷均能在空气中燃烧,且燃烧产物相同,但二者的燃烧热不同,通过实验可测得这两个反应的反应热。
① P4(s,白磷)+
P4(s,白磷)+ O2(g)===
O2(g)=== P4O10(s) ΔH1=-745.8 kJ·mol-1
P4O10(s) ΔH1=-745.8 kJ·mol-1
②4P(s,红橉)+5O2(g)===P4O10(s) ΔH2=-2954 kJ·mol-1
(1)白磷和红磷的关系是_____________。
a.同一种物质 b.同位素 c.同分异构体 D.同素异形体
(2)红磷的燃烧热是________kJ·mol-1,白磷的燃烧热比红磷的燃烧热___________(填“大”或“小”)。
(3)白磷转化为红磷的热化学方程式为P4(s,白磷)===4P(s,红磷)ΔH=-29.2 kJ·mol-1。在相同的条件下,能量较低的是________(填“白磷”或“红磷”),白磷的稳定性比红磷________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017年河北定州中学承智班高二上第一次月考化学卷(解析版) 题型:选择题
普及化学知识有助于人们树立健康的观念。下列观念正确的是( )
A.天然物质都是绿色无毒的物质
B.只饮用纯净水有益人体健康
C.禁止吸烟可减少室内空气污染
D.微量元素只能通过保健品摄入
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com