
| A. | 溶液、胶体和悬浊液三种分散系的本质区别是分散质微粒直径的大小 | |
| B. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其正极上发生的反应为:CH3OH-6e-+8OH-=CO32-+6H2O | |
| C. | 在铁上镀铜时,金属铜作阴极 | |
| D. | 电解法精炼铜时,电解质溶液中铜离子浓度一定不变 |
分析 A.根据分散质微粒大小将分散系分为:溶液、胶体和浊液;
B.甲醇燃料碱性电池中,正极上氧化剂得电子发生还原反应;
C.电镀时,镀层作阳极、镀件作阴极;
D.电解精炼粗铜时,阳极上溶解的铜小于阴极上析出的铜.
解答 解:A.根据分散质微粒大小将分散系分为:溶液、胶体和浊液,微粒直径在1-100nm之间的为胶体,故A正确;
B.甲醇燃料碱性电池中,正极上氧化剂得电子发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,故B错误;
C.电镀时,镀层作阳极,镀件作阴极,所以在铁上镀铜,铜作阳极,铁作阴极,故C错误;
D.电解精炼粗铜时,阳极上不仅铜失电子还有其它金属失电子,阴极上只有铜离子得电子,根据转移电子守恒知,阳极上溶解的铜小于阴极上析出的铜,所以电解质溶液中铜离子浓度减小,故D错误;
故选A.
点评 本题考查了电解池原理、原电池原理、分散系的划分等知识点,明确电解池、原电池各个电极上发生的反应即可解答,难点是电极反应式的书写,易错选项是B,注意碱性电池中,电极反应式的生成物中不能生成氢离子,酸性电池中,电极反应式的生成物中不能含有氢氧根离子,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 将Na2O2固体加入水中:Na2O2+2H2O=2Na++2OH-+O2↑ | |
| B. | Ba(OH)2溶液与硫酸的反应:OH-+H+=H2O | |
| C. | Cl2溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 少量CO2通入澄清石灰水中:CO2+2OH-+Ca2+═Ca CO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大N2O4的浓度 | B. | 增大NO2的浓度 | C. | 升高体系的温度 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
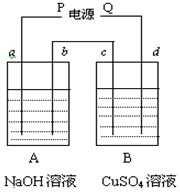 按如图装置实验,a、b、c、d均为惰性电极,A、B两烧杯中分别盛放NaOH溶液和足量CuSO4溶液.通电一段时间后,c电极质量增加6.4g,试回答:
按如图装置实验,a、b、c、d均为惰性电极,A、B两烧杯中分别盛放NaOH溶液和足量CuSO4溶液.通电一段时间后,c电极质量增加6.4g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu是负极 | |
| C. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 | |
| D. | 马口铁(镀锡铁)破损时与电解质溶液接触,锡先被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
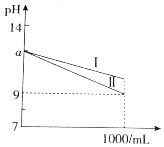
| A. | 曲线Ⅰ表示NaOH溶液中pH的变化 | |
| B. | 开始时两溶液中水的电离程度相同 | |
| C. | 由图象可知,开始时c(NaOH)=0.01mol•L-1 | |
| D. | 在稀释过程中氨水溶液中的$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LHF所含的分子数为0.5NA | |
| B. | 常温下,100mL2mol/L的明矾溶液净水时,生成具有净水作用的微粒数为0.2NA | |
| C. | 常温下,1L0.1mol/LNH4NO3溶液中氧原子数为0.3NA | |
| D. | 标准状况下,4.2gCH2=CH2和CH3CH=CH2的混合气体中所含有的氢原子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅晶体广泛应用于电子工业的各个领域 | |
| B. | 氧化镁是优质的耐高温材料 | |
| C. | 明矾净水剂正逐步被含铁净水剂所取代 | |
| D. | 用铝制餐具长时间存放碱性食物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com