
| A. | ①③⑤ | B. | ②⑤ | C. | ④⑤ | D. | ②⑤⑥ |
分析 ①0.1mol•L-1NaHSO4溶液体积不明确;
②求出12g 石墨的物质的量,然后根据1mol石墨中含1.5mol共价键来分析;
③Na2O2与水的反应为歧化反应;
④Na2CO3 溶液中,除了碳酸钠外,水也含氧原子;
⑤NaHCO3溶液中所有氢氧根均来自于水的电离;
⑥氯气和水的反应为可逆反应.
解答 解:①0.1mol•L-1NaHSO4溶液体积不明确,故溶液中的阳离子的个数无法计算,故错误;
②12g 石墨的物质的量为1mol,而1mol石墨中含1.5mol共价键,故含1.5NA个,故正确;
③Na2O2与水的反应为歧化反应,1mol过氧化钠转移1mol电子即NA个,故错误;
④Na2CO3 溶液中,除了碳酸钠外,水也含氧原子,故溶液中的氧原子的个数多于0.3NA个,故错误;
⑤NaHCO3溶液中所有氢氧根均来自于水的电离,而pH=12的溶液中,氢氧根的浓度为0.01mol/L,故1L溶液中氢氧根的物质的量为0.01mol,个数为0.01NA个,均来自于水的电离,故正确;
⑥氯气和水的反应为可逆反应,故不能进行彻底,故转移的电子数小于NA个,故错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O |
| B | Mg2+、Cl-、HCO3- | 过量NaOH溶液 | Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
| C | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+═SO2↑+H2O |
| D | K+、CO32-、NH3•H2O | 通入少量CO2 | CO32-+CO2+2H2O═2HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
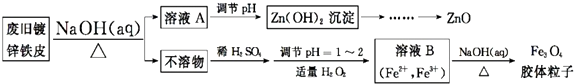
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验必须使用温度计,且温度计的水银球应在蒸馏烧瓶的支管口处 | |
| B. | 冷凝管中的水流方向是从下口进入,上口排出 | |
| C. | 实验中需要在蒸馏烧瓶中加入几片碎瓷片,防止出现暴沸现象 | |
| D. | 用酒精灯加热时,蒸馏烧瓶必须垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
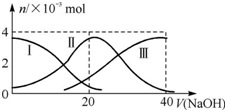 常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )
常温下,向20mL 0.2mol•L-1 H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如图所示.根据图示判断下列说法正确的是( )| A. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 | |
| C. | NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1013的溶液中:NH4+、Ca2+、C1-、K+ | |
| B. | 澄清透明的无色溶液中:K+、Mg2+、NO3-、MnO4- | |
| C. | 使pH试纸呈红色的溶液中:I-、Cl-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液中:K+、Ca2+、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
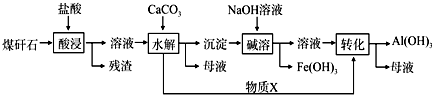
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com