
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
分析 (1)金属导热快,热量损失多;
(2)中和热测定实验成败的关键是保温工作;
(3)先求出三次反应的温度差,根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出反应热,氢氧化钠固体溶于水放热;
(4)根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低,根据实验中用到的试剂以及实验操作知识来判断.
解答 解:(1)不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体,故答案为:Cu传热快,热量损失大;
(2)中和热测定实验主要目的是测量反应放出的热量多少,所以实验成败的关键是保温工作,所以提高中和热测定准确性的关键是提高装置的保温效果,故答案为:提高装置的保温效果;
(3)(2)第1次实验盐酸和NaOH溶液起始平均温度为20.25℃,反应前后温度差为:3.45℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.40℃,反应前后温度差为:3.40℃;
第3次实验盐酸和NaOH溶液起始平均温度为21.55℃,反应前后温度差为:3.35℃;
三次温度差的平均值为3.40℃,
50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液的质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.40℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为$\frac{1.4212kJ}{0.025mol}$=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;氢氧化钠固体溶于水放热,所以实验中测得的“中和热”数值将偏大
故答案为:-56.8 kJ/mol;偏大;氢氧化钠固体溶于水放热;
(4)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,碱的温度偏高,温度差偏小,导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,电离时要吸热,温度差偏小,导致实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,酸过量,可以保证碱全反应,温度差偏大,会使得中和和热的测定数据偏高,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低,故F正确.
故选ABDF.
点评 本题考查中和热的测定,题目难度中等,注意热量计算公式的应用中c=4.18J/(g•℃),要注意热量单位的换算,侧重于考查学生的实验能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .请根据如图回答:
.请根据如图回答:
 .
. ;④
;④ .
. +C2H5OH
+C2H5OH查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
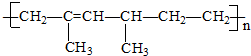
| A. | 2,4-二甲基-2-已烯 | B. | 2,4-二甲基-1,3-已二烯 | ||
| C. | 乙烯和2-甲基-1,3-戊二烯 | D. | 烯和2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤①② | B. | ①②⑤③④ | C. | ⑤④③②① | D. | ③④⑤②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 固体2是Fe2O3 | |
| B. | 溶液甲中可能含有Fe3+ | |
| C. | X的化学式可以表示为Fe3C2 | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2通入足量水中转移电子数为NA | |
| B. | 在0℃、101kPa时,22.4L H2中含有NA个H | |
| C. | 14gN2中含有7NA个电子 | |
| D. | NA个CO分子和0.5molCH4的质量比为7:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com