
 A”¢B”¢C”¢D”¢E”¢FŹĒ¶ĢÖÜĘŚŌŖĖŲ£¬ÖÜĘŚ±ķÖŠAÓėB”¢BÓėCĻąĮŚ£»CÓėEĶ¬Ö÷×壻AÓėC×īĶā²ćµē×ÓŹżÖ®±ČĪŖ2£ŗ3£¬BµÄ×īĶā²ćµē×ÓŹż±ČCµÄ×īĶā²ćµē×ÓŹżÉŁ1øö£» FŌŖĖŲµÄŌ×ÓŌŚÖÜĘŚ±ķÖŠ°ė¾¶×īŠ”£»³£¼ū»ÆŗĻĪļD2C2ÓėĖ®·“Ӧɜ³ÉCµÄµ„ÖŹ£¬ĒŅČÜŅŗŹ¹·ÓĢŖČÜŅŗ±äŗģ£®
A”¢B”¢C”¢D”¢E”¢FŹĒ¶ĢÖÜĘŚŌŖĖŲ£¬ÖÜĘŚ±ķÖŠAÓėB”¢BÓėCĻąĮŚ£»CÓėEĶ¬Ö÷×壻AÓėC×īĶā²ćµē×ÓŹżÖ®±ČĪŖ2£ŗ3£¬BµÄ×īĶā²ćµē×ÓŹż±ČCµÄ×īĶā²ćµē×ÓŹżÉŁ1øö£» FŌŖĖŲµÄŌ×ÓŌŚÖÜĘŚ±ķÖŠ°ė¾¶×īŠ”£»³£¼ū»ÆŗĻĪļD2C2ÓėĖ®·“Ӧɜ³ÉCµÄµ„ÖŹ£¬ĒŅČÜŅŗŹ¹·ÓĢŖČÜŅŗ±äŗģ£®·ÖĪö øł¾Ż³£¼ū»ÆŗĻĪļD2C2ÓėĖ®·“Ӧɜ³ÉCµÄµ„ÖŹ£¬ĒŅČÜŅŗŹ¹·ÓĢŖŹŌŅŗ±äŗģ£¬æÉÖŖCĪŖOŌŖĖŲ£¬DĪŖNaŌŖĖŲ£¬BµÄ×īĶā²ćµē×ÓŹż±ČCµÄ×īĶā²ćµē×ÓŹżÉŁ1øö£¬ŌņBµÄ×īĶā²ćµē×ÓŹżĪŖ5£¬ĒŅĻąĮŚ£¬Ó¦ĪŖNŌŖĖŲ£¬CÓėEĶ¬Ö÷×壬EÓ¦ĪŖSŌŖĖŲ£¬AÓėBĻąĮŚ£¬AÓėEµÄ×īĶā²ćµē×ÓŹżÖ®±Č2£ŗ3£¬ŌņAµÄ×īĶā²ćµē×ÓŹżĪŖ4£¬Ó¦ĪŖCŌŖĖŲ£¬FŌŖĖŲµÄŌ×ÓŌŚÖÜĘŚ±ķÖŠ°ė¾¶×īŠ”£¬FÓ¦ĪŖHŌŖĖŲ£¬¾Ż“Ė“šĢā£®
½ā“š ½ā£ŗøł¾Ż³£¼ū»ÆŗĻĪļD2C2ÓėĖ®·“Ӧɜ³ÉCµÄµ„ÖŹ£¬ĒŅČÜŅŗŹ¹·ÓĢŖŹŌŅŗ±äŗģ£¬æÉÖŖCĪŖOŌŖĖŲ£¬DĪŖNaŌŖĖŲ£¬BµÄ×īĶā²ćµē×ÓŹż±ČCµÄ×īĶā²ćµē×ÓŹżÉŁ1øö£¬ŌņBµÄ×īĶā²ćµē×ÓŹżĪŖ5£¬ĒŅĻąĮŚ£¬Ó¦ĪŖNŌŖĖŲ£¬CÓėEĶ¬Ö÷×壬EÓ¦ĪŖSŌŖĖŲ£¬AÓėBĻąĮŚ£¬AÓėEµÄ×īĶā²ćµē×ÓŹżÖ®±Č2£ŗ3£¬ŌņAµÄ×īĶā²ćµē×ÓŹżĪŖ4£¬Ó¦ĪŖCŌŖĖŲ£¬FŌŖĖŲµÄŌ×ÓŌŚÖÜĘŚ±ķÖŠ°ė¾¶×īŠ”£¬FÓ¦ĪŖHŌŖĖŲ£¬
£Ø1£©BµÄĆū³ĘĪŖµŖŌŖĖŲ£¬°±ĘųæÉŹ¹ŹŖČóµÄŗģÉ«ŹÆČļŹŌÖ½±äĄ¶£¬¹Ź“š°øĪŖ£ŗµŖŌŖĖŲ£»ŹŖČóµÄŗģÉ«ŹÆČļ£»Ą¶£»
£Ø2£©ÓÉB”¢C”¢FČżÖÖŌŖĖŲÖŠµÄĮ½ÖÖæÉŠĪ³É10µē×ÓµÄĪ¢Į£ÓŠĪåÖÖ·Ö±šĪŖNH3”¢H2O”¢NH4+”¢OH-”¢H3O+£ŗ
¢ŁČōP”ŁKŌņ·¢ÉśNH3+H3O+=H2O+NH4+£¬MŗĶN·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖNH3+H3O+=H2O+NH4+£¬¹Ź“š°øĪŖ£ŗNH3+H3O+=H2O+NH4+£»
¢ŚČōP=KŌņŌņ·¢ÉśOH-+H3O+=2H2O£¬MŗĶN·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖOH-+H3O+=2H2O£¬¹Ź“š°øĪŖ£ŗOH-+H3O+=2H2O£»
¢ŪĘäÖŠĖÄŗĖ¹¹³ÉµÄ10µē×ÓĪ¢Į£µē×ÓŹ½ĪŖNH3”¢H3O+£¬¹Ź“š°øĪŖ£ŗNH3”¢H3O+£»
£Ø3£©F2CŹĒĖ®£¬F2EŹĒĮņ»ÆĒā£¬Ė®·Ö×ÓÓė·Ö×ÓÖ®¼ä“ęŌŚĒā¼ü£¬¶ųĮņ»ÆĒā·Ö×Ó¼äĪŽĒā¼ü£¬ĖłŅŌĖ®µÄ·ŠµćøßÓŚĮņ»ÆĒā£¬¹Ź“š°øĪŖ£ŗĖ®·Ö×ÓÓė·Ö×ÓÖ®¼ä“ęŌŚĒā¼ü£»
£Ø4£©C”¢D”¢E”¢FĖÄÖÖŌŖĖŲµÄĮ½ÖÖ»ÆŗĻĪļĻą»„¼ä·¢Éś·“Ó¦£¬ĒŅÉś³ÉĘųĢ壬Į½ÖÖ»ÆŗĻĪļĪŖNaHSO3”¢NaHSO4£¬ŌŚČÜŅŗÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ HSO3-+H+=SO2”ü+H2O£®
¹Ź“š°øĪŖ£ŗHSO3-+H+=SO2”ü+H2O£®
µćĘĄ ±¾ĢāÖ÷ŅŖæ¼²éĮĖµē×ÓŹ½”¢ŌŖĖŲÖÜĘŚĀÉ”¢»Æѧ¼ü”¢Ąė×Ó·“Ó¦”¢øł¾Ż»Æѧ·½³ĢŹ½µÄ¼ĘĖćµČÖŖŹ¶µć£¬ÖŠµČÄŃ¶Č£¬½āĢāµÄ¹Ų¼üŌŚÓŚøł¾ŻŌŖĖŲµÄŠŌÖŹČ·¶ØŌŖĖŲÖÖĄą£¬µŚ£Ø4£©Š”ĪŹ¼ĘĖćŹ±×¢Ņā»Æѧ¼ĘĖćµÄ»ł±¾·½·ØµÄŌĖÓĆ£®


 ĆūŹ¦µć²¦¾ķĻµĮŠ“š°ø
ĆūŹ¦µć²¦¾ķĻµĮŠ“š°ø Ó¢²Å¼Ę»®ĘŚÄ©µ÷ŃŠĻµĮŠ“š°ø
Ó¢²Å¼Ę»®ĘŚÄ©µ÷ŃŠĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | æÉŅŌŗĶ¼ī·“Ó¦ | B£® | “ĪĀČĖį¾ßÓŠĘư׊Ō | ||
| C£® | “ĪĀČĖį²»ĪČ¶Ø”¢¼ū¹āŅ×·Ö½ā | D£® | “ĪĀČĖįøĘæÉŗĶĢ¼Ėį·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Z”¢Y”¢X”¢WµÄŌ×Ó°ė¾¶ŅĄ“Ī¼õŠ” | |
| B£® | WÓėXŠĪ³ÉµÄ»ÆŗĻĪļÖŠÖ»ŗ¬Ąė×Ó¼ü | |
| C£® | WµÄĘųĢ¬Ēā»ÆĪļµÄ·ŠµćŅ»¶ØøßÓŚZµÄĘųĢ¬Ēā»ÆĪļµÄ·Šµć | |
| D£® | ČōX?Y?W×é³ÉµÄ¼ņµ„Ąė×Óµē×Ó²ć½į¹¹ĻąĶ¬£¬ŌņWĄė×Ó°ė¾¶×ī“ó£® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 ČēĶ¼ĪŖijĪĀ¶ČĻĀ£¬CuS£Øs£©”¢ZnS£Øs£©”¢FeS£Øs£©·Ö±šŌŚČÜŅŗÖŠ“ļµ½³ĮµķČܽāĘ½ŗāŗó£¬ČÜŅŗÖŠS2-ÅØ¶Č£¬½šŹōŃōĄė×ÓÅØ¶Č±ä»ÆĒéæö£®Čē¹ūĻņŗ¬ÓŠÕāČżÖÖ³ĮµķµÄ»ģŗĻĪļÖŠ¼ÓŃĪĖį£¬×īĻČČܽāµÄŹĒFeS£®
ČēĶ¼ĪŖijĪĀ¶ČĻĀ£¬CuS£Øs£©”¢ZnS£Øs£©”¢FeS£Øs£©·Ö±šŌŚČÜŅŗÖŠ“ļµ½³ĮµķČܽāĘ½ŗāŗó£¬ČÜŅŗÖŠS2-ÅØ¶Č£¬½šŹōŃōĄė×ÓÅØ¶Č±ä»ÆĒéæö£®Čē¹ūĻņŗ¬ÓŠÕāČżÖÖ³ĮµķµÄ»ģŗĻĪļÖŠ¼ÓŃĪĖį£¬×īĻČČܽāµÄŹĒFeS£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČōijÄĘŃĪČÜŅŗŗ¬¼×µēĄė³öµÄŅõĄė×Ó£¬ŌņøĆČÜŅŗ¼ČæÉÄÜÓėĖį·“Ó¦ÓÖæÉÄÜÓė¼ī·“Ó¦ | |
| B£® | ČōŅŅÓėŃõĘųµÄĦ¶ūÖŹĮæĻąĶ¬£¬ŌņŅŅÖ»ÄÜÓÉ2ÖÖŌŖĖŲ×é³É | |
| C£® | Čō±ūÖŠŗ¬ÓŠµŚ2ÖÜĘŚ¢ōA×åµÄŌŖĖŲ£¬Ōņ±ūæÉÄÜŹĒ¼×ĶéµÄĶ¬ĻµĪļ | |
| D£® | Čō¶”ÖŠø÷ŌŖĖŲÖŹĮæ±Čøś¼×ÖŠø÷ŌŖĖŲÖŹĮæ±ČĻąĶ¬£¬Ōņ¶”ÖŠŅ»¶Øŗ¬ÓŠ-1¼ŪµÄŌŖĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £Ø1£©»ś¶Æ³µĪ²ĘųŗĶČ¼ÉÕ²śÉśµÄŃĢĘųŗ¬µŖµÄŃõ»ÆĪļ£¬æÉŅŌÓĆCH4“߻ƻ¹ŌNOxĻū³żµŖŃõ»ÆĪļµÄĪŪČ¾£®
£Ø1£©»ś¶Æ³µĪ²ĘųŗĶČ¼ÉÕ²śÉśµÄŃĢĘųŗ¬µŖµÄŃõ»ÆĪļ£¬æÉŅŌÓĆCH4“߻ƻ¹ŌNOxĻū³żµŖŃõ»ÆĪļµÄĪŪČ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
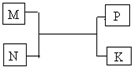
 ¶ĢÖÜĘŚŌŖĖŲX”¢Y”¢Z”¢WŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠWµÄŃõ»ÆĪļŹĒŠĪ³ÉĖįÓźµÄÖ÷ŅŖĪļÖŹÖ®Ņ»£®
¶ĢÖÜĘŚŌŖĖŲX”¢Y”¢Z”¢WŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠWµÄŃõ»ÆĪļŹĒŠĪ³ÉĖįÓźµÄÖ÷ŅŖĪļÖŹÖ®Ņ»£®| X | |||
| Z | W | Y |
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ü | B£® | ¢Ż | C£® | ¢Ł¢Ś¢Ū | D£® | ¢Ł¢Ś¢Ū¢Ü |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com