
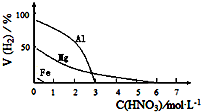
 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:| 影响因素 | 实验步骤 | 实验结论 |
| 金属的种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入2mol•L-1 HNO3溶液50mL,反应结束后,用气体分析仪测定气体中H2的体积分数 | 在该浓度的稀HNO3中,Mg能反应, Fe粉不反应, |
| 硝酸的浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入0.1mol•L-1HNO3、2.0mol•L-1HNO3,反应结束后,用气体分析仪测定气体中H2的体积分数 | 硝酸浓度越稀,产生氢气越多. |
分析 (1)浓度不同HNO3氧化性不同,如浓硝酸能与碳反应,而稀硝酸不能;
(2)钝化是在金属的表面形成致密的氧化膜,只有两种金属铁和铝;
(3)根据题中信息,王水与金的反应中,反应物为金、硝酸根离子、氢离子、氯离子,生成物为AuCl4-、NO和水,据此写出反应的离子方程式;
(4)据N化合价下降的规律得出,氮元素化合价+5、+4、+3、+2、+1、-3;
(5)看图分析答题;金属与HNO3反应是放热反应,温度也会影响金属与HNO3反应产生H2,故要降温,选择实验方法.
解答 解:(1)浓度不同HNO3氧化性不同,浓硝酸的氧化性大于稀硝酸,如浓硝酸能与碳反应,而稀硝酸不能,
故答案为:浓硝酸能与碳反应,而稀硝酸不能;
(2)钝化是常温下,在金属的表面形成致密的氧化膜,只有两种金属铁和铝在两种酸中形成,分别为常温下Fe和Al在浓硫酸和浓硝酸中,
故答案为:Fe、Al;
(3)由题中信息可知,金与王水反应的离子方程式为:4H++NO3-+Au?NO+Au3++2H2O、Au3++4Cl-=AuCl4-,反应的总离子方程式为:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O,
故答案为:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O;
(4)据N化合价下降的规律得出,空格的两个依次为0价和-3价,故物质为:N2、NH4+(或硝酸铵NH4NO3),
故答案为:N2、NH4+(或硝酸铵NH4NO3);
(5)看图中受硝酸浓度和金属种类影响;HNO3的浓度有两种:0.1mol•L-1、2.0mol•L-1,看图可知:HNO3的浓度大于0.50mol•L-1时,铁不反应,故选HNO3的浓度2.0mol•L-1;两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,即为金属相同,当然选不同浓度的硝酸来实验,看图得到实验结论为硝酸浓度越稀,产生氢气越多;金属与HNO3反应是放热反应,温度也会影响金属与HNO3反应产生H2,故要降温,选择冷水浴中进行实验.
故答案为:
| 实验步骤 | 实验结论 | |
| 金属的种类 | 2 | Fe粉 |
| 硝酸的浓度 | 0.1mol•L-1HNO3、2.0mol•L-1HNO3 | 越稀 |
点评 本题考查离子方程式的书写、看图分析能力,题目难度中等,注意掌握离子方程式的书写方法,试题培养了学生的看图分析、理解能力.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2与足量的水反应,转移的电子数为2NA | |
| B. | 17g羟基中含有的电子数为10NA | |
| C. | 标准状况下,1mol已烷中共价键数目为19NA | |
| D. | 1L 0.10mol•L-1的Na2CO3溶液中阴离子数目之和小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 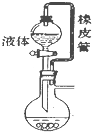 橡皮管能使液体顺利流下 | B. | 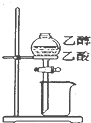 分离乙醇和乙酸 | ||
| C. | 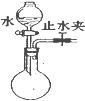 检查装置气密性 | D. | 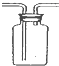 收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com