
分析 (1)为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、量筒、100mL容量瓶、胶头滴管、玻璃棒等;
(2)高锰酸钾具有强氧化性,会腐蚀碱式滴定管中的橡皮管;
(3)在滴定过程中,目光应注视锥形瓶中溶液颜色的变化;滴定终点时溶液颜色无色变化为紫色且在30s内颜色不再恢复为原来颜色,证明反应达到终点;
(4)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,根据关系式2KMnO4~5H2C2O4计算25.0mL草酸溶液中n(H2C2O4),进而计算100mL草酸溶液中n′(H2C2O4),计算草酸的质量,根据化学式质量分数计算求X的值.
解答 解:(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等,故还需要100mL容量瓶、胶头滴管、玻璃棒,
故答案为:100mL容量瓶、胶头滴管、玻璃棒;
(2)KMnO4溶液具有强氧化性,可以腐蚀碱式滴定管中的橡皮管,故KMnO4溶液应装在酸式滴定管中;
故答案为:酸式滴定管;KMnO4具有强氧化性,会腐蚀碱式滴定管中的橡皮管;
(3)KMnO4溶液呈紫色,草酸反应完毕,当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
故答案为:滴入最后一滴,待测液刚好出现紫色且半分钟内不褪色;
(4)滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,
n(KMnO4)=c mol•L-1×(b-a)×10-3L=c×(b-a)×10-3mol,
根据关系式2KMnO4~5H2C2O4可知25.0mL草酸溶液中n(H2C2O4)=2.5×c×(b-a)×10-3mol,
则100mL草酸溶液中n′(H2C2O4)=2.5×c×(b-a)×10-3mol×$\frac{100mL}{25mL}$=c×(b-a)×10-2mol,
草酸晶体中草酸的质量为c×(b-a)×10-2mol×90g/mol=0.9c(b-a)g,
由化学式可知:$\frac{90}{90+18x}$=$\frac{c×(b-a)×1{0}^{-2}mol×90g/mol}{Wg}$,解得x=$\frac{50W}{9c(b-a)}$-5,
故答案为:$\frac{50W}{9c(b-a)}$-5.
点评 本题考查氧化还原滴定与计算,难度中等,注意滴定时注意根据关系式进行计算,掌握根据关系式计算方法,侧重于考查学生的实验能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 5 | C. | 6 | D. | 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③④ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验示意图 | 实验现象 | 解释 |
甲: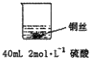 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) 滴定前读数(mL)滴定后读数(mL) | |
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
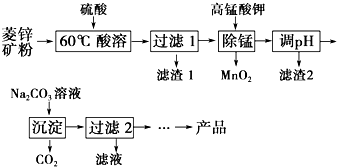 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
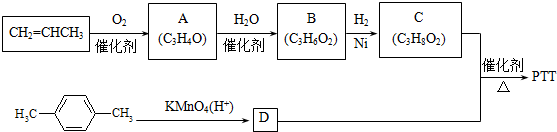
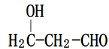 .
.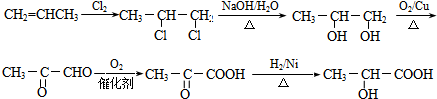 .
.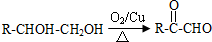
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com