
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为: SO2 7% ,O2 11%,N2 82%):
SO2 7% ,O2 11%,N2 82%):

(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
【答案】
(1)压强一定时,温度升高时,SO2转化率下降,说明升温有利于逆反应进行,所以正反应为放热反应;
(2)增大压强对提高SO2转化率无显著影响,反而会增加成本;
(3)否 否
(4)浓硫酸
(5)解:1万吨98%的硫酸含H2SO4的质量:9.8×109g
设需要SO3的质量为x,该反应产生的热量为y。
H2SO4 — SO3 — △H
98g 80g -196.6×0.5KJ
9.8×109g x y
x= =8.0×10×9g=8.0×103t
=8.0×10×9g=8.0×103t
y= =9.83×109kJ
=9.83×109kJ
【解析】由表中的数据,在压强相同条件下升高温度,SO2的转化率降低,平衡向左移动,正反应为放热反应。当增大压强时SO2的转化率变化不大,且常压下转化率已较大。使用催化剂加快反应速率,平衡不移动,转化率不变,也不能增大反应放出热量,因为参加反应的量没变化。为了防止形成酸雾不利于SO3吸收,实际上用浓H2SO4来吸收SO3。由1万吨98%硫酸中H2SO4的量来计算SO3质量及放出热量。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
《化学与技术》模块(选考题)
普钙是目前使用最广泛的磷肥,其主要成分是( )
A.Ca5(PO4)3F
B.Ca(H2PO4)2·H2O和CaSO4
C.Ca3(PO4)2和CaHPO4
D.CaHPO4和Ca(H2PO4)2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象的描述错误的是
A. 氢气在氯气中燃烧生成绿色烟雾
B. 红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C. 点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸 雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是 ;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子 质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强
D 减小压强 E 加入催化剂 G 移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要的化工原料,反应的化学方程式为
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,向100 mL氢硫酸溶液中通人二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为
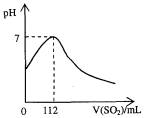
A.0.5 mol/L B.0.05 mol/L
C.1 mol/L D.0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是______________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是___________________,此液体具有的性质是______(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于“过氧化氢”的说法正确的是
A.过氧化氢具有杀菌消毒作用,是强酸
B.过氧化氢是离子化合物
C.过氧化氢可以发生分解反应
D.过氧化氢是水的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学科研小组研究合成氨:N2(g)+3H2(g)  2NH3(g);△H<0,在其他条件不变时,改变某一条件时对化学平衡的影响,得到如下图像,以下对应选项中正确的是( )
2NH3(g);△H<0,在其他条件不变时,改变某一条件时对化学平衡的影响,得到如下图像,以下对应选项中正确的是( )




A.(1)对应的是:在t1时恒压条件下,通入NH3
B. (2)对应的是:氨气在恒容不同温度下的百分含量
C.(3)对应的是:在恒容条件下,反应速率与温度的关系
D. (4)对应的是:N2转化率与温度(T1>T2)、压强的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com