
【题目】我国化工专家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
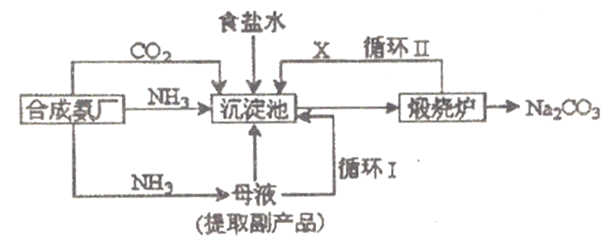
(1)上述流程中X物质的电子式为__________________。
(2)沉淀池中发生的化学反应方程式是_______________________,煅烧炉中发生的化学反应方程式是___________________________。
(3)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______________________
(4)请你再写出一种实验室制取少量碳酸氢钠的方法:(用化学反应方程式来描述)_____________________________。
(5)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学按如下方案进行
实验:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
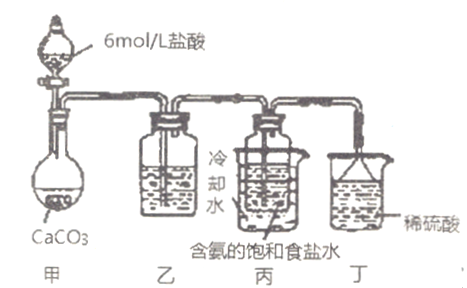
请回答:
①甲中发生反应的离子方程式是_____________________。
丁中发生反应的离子方程式是__________________。
②乙装置中的试剂是___________________。
【答案】 ![]() NH3+H2O+CO2+NaCl=+NaHCO3↓或NH3+H2O+CO2=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl 2NaHCO3
NH3+H2O+CO2+NaCl=+NaHCO3↓或NH3+H2O+CO2=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+H2O+CO2 碳酸氢钠的溶解度相对小 NaOH+CO2=NaHCO3;或Na2CO3+CO2+H2O=2NaHCO3 CaCO3+2H+=Ca2++CO2↑+H2O NH3+H+=NH4+ 饱和NaHCO3溶液
Na2CO3+H2O+CO2 碳酸氢钠的溶解度相对小 NaOH+CO2=NaHCO3;或Na2CO3+CO2+H2O=2NaHCO3 CaCO3+2H+=Ca2++CO2↑+H2O NH3+H+=NH4+ 饱和NaHCO3溶液
【解析】本题考查化学工艺流程和实验方案设计与评价,(1)根据流程图,沉淀池制备碳酸氢钠,沉淀池发生NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,煅烧炉发生2NaHCO3 ![]() Na2CO3+CO2↑+H2O,气体X为CO2,其电子式为
Na2CO3+CO2↑+H2O,气体X为CO2,其电子式为![]() ;(2)根据(1)的分析,沉淀池中发生的是NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,碳酸氢钠不稳定,受热易分解,煅烧炉中发生的是2NaHCO3
;(2)根据(1)的分析,沉淀池中发生的是NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,碳酸氢钠不稳定,受热易分解,煅烧炉中发生的是2NaHCO3 ![]() Na2CO3+CO2↑+H2O;(3)因为碳酸氢钠的溶解度相对较小,因此NH4HCO3+NaCl=NaHCO3↓+NH4Cl;(4)NaOH+CO2=NaHCO3;或Na2CO3+CO2+H2O=2NaHCO3;(5)①甲中发生的反应是CaCO3+2H+=Ca2++CO2↑+H2O;丙中盛放的是含氨的饱和食盐水,会有少量NH3挥发,因此装置丁的作用是除去挥发的NH3,即离子方程式NH3+H+=NH4+;②盐酸具有挥发性,产生的CO2中混有HCl,干扰NaHCO3的制备,必须除去HCl,除去CO2中混有HCl,常用饱和的碳酸氢钠溶液,即乙装置盛放饱和NaHCO3溶液。
Na2CO3+CO2↑+H2O;(3)因为碳酸氢钠的溶解度相对较小,因此NH4HCO3+NaCl=NaHCO3↓+NH4Cl;(4)NaOH+CO2=NaHCO3;或Na2CO3+CO2+H2O=2NaHCO3;(5)①甲中发生的反应是CaCO3+2H+=Ca2++CO2↑+H2O;丙中盛放的是含氨的饱和食盐水,会有少量NH3挥发,因此装置丁的作用是除去挥发的NH3,即离子方程式NH3+H+=NH4+;②盐酸具有挥发性,产生的CO2中混有HCl,干扰NaHCO3的制备,必须除去HCl,除去CO2中混有HCl,常用饱和的碳酸氢钠溶液,即乙装置盛放饱和NaHCO3溶液。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)实验室配制1000mL0.50mol·L-1的Na2CO3溶液,在常用仪器中应选用______mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度______0.50mol·L-1(填“大于”、“小于”或“等于”)。
(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在______式滴定管中。若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
则c(HCl)=______mol·L-1。
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______,若原来配制所称取的Na2CO3固体中混有Na2CO3·10H2O,则实验误差为______(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:

①请写出AB段反应的离子方程式___________________________________
当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)_____________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2反应制备二甲醚(CH3OCH3)的条件是压力2.0~10.0MPa,温度300℃。设备中进行下列反应,请回答下列问题:
①CO(g)+2H2(B)![]() CH3OH(g) △H=-90.7kJ/mol
CH3OH(g) △H=-90.7kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
(1)总反应3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)的△H=_____________ 。据此可判断该反应_________________条件下自发。
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是_____
a.容器中压强保持不变 b.混合气体中c(CO)不变
c.v正(CO)= v逆(H2) d.c(CH3OH)= c(CO)
(3)在2L 的容器中加入amol CH3OH(g)发生反应②,达到平衡后若再加入amolCH3OH(g)重新达到平衡时,CH3OH 的转化率____________(填“增大”、“ 减小”或“不变”)。
(4)850℃时在一体积为10L 的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示。
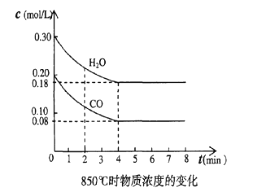
①0~4min 的平均反应速率,v(CO)=________________ 。
②若温度不变,向该容器中加入4mo1CO(g)、2mo1H2O(g)、3mo1CO2(g)和3molH2(g),起始时v正(CO)______v逆(H2)(填“<”、“ >”或“=”),请结合必要的计算说明理由。________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下N2H4为液体,可作为火箭发动机的燃料,与氧化剂N2O4发生反应:2N2H4 + N2O4 ![]() 3N2 + 4H2O。分子球棍模型如下图所示,NA为阿伏加德罗常数的值,下列叙述正确的是
3N2 + 4H2O。分子球棍模型如下图所示,NA为阿伏加德罗常数的值,下列叙述正确的是
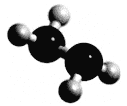
A. 32 g N2H4中含有共用电子对数为6 NA
B. 标准状况下,22.4L N2H4中含有的分子数为NA
C. N2H4和N2O4混合的总物质的量为1mol时,含氮原子数为4 NA
D. 上述反应消耗1mol N2H4,转移电子数为4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是

A. 过程Ⅰ得到的Li3N中N元素为-3价
B. 过程Ⅱ生成W的反应:Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量转化的形式:化学能转变为电能
D. 过程Ⅲ涉及到反应:4OH-4 e-=== O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法正确的是
A. c(NH![]() ):③<①
):③<①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(Cl-)>c(NH![]() ) >c(OH-)>c(H+)
) >c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com