
【题目】甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理有如下两种:①CH3OH(g)+H2O(g) = CO2(g)+3H2(g)ΔH = + 49.0 kJ·mol-1②CH3OH(g)+![]() O2(g) = CO2(g)+2H2(g) H = - 192.9 kJ·mol-1,下列说法正确的是( )
O2(g) = CO2(g)+2H2(g) H = - 192.9 kJ·mol-1,下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如图所示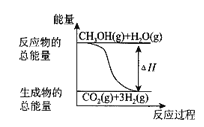
C.CH3OH转变成H2的过程一定要放出能量
D.根据②推知反应:CH3OH(l)+ ![]() O2(g) = CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g) = CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05molB.1molC.1.05molD.0.13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,在4L密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:

(1)t1时刻N的转化率为____________。
(2)0~t3时间内用M表示的化学反应速率为____________mol/(L·min)。
(3)平衡时容器内气体的压强与起始时容器内压强的比值为____________。
(4)该反应的化学方程式为______;t2时刻,正逆反应速率大小:v正 ____v逆(填“>”、“=”或“<”)。
(5)下列能表示上述反应达到化学平衡状态的是____________(填编号)
A.v逆(M)=2v正(N) B.M与N的物质的量之比保持不变
C.混合气体密度保持不变 D.容器中压强保持不变
(6)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁_______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
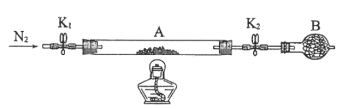
①仪器B的名称是________。
②将下列实验操作步骤正确排序_______(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.打开K1和K2,缓缓通入N2 c.关闭K1和K2
d.熄灭酒精灯 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_______(列式表示)。若实验时按a、b次序操作,则使x_______(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
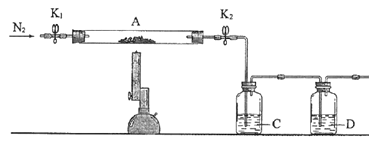
①C中的溶液为BaCl2,其作用是______。D溶液为______,D中可观察到的现象为_______。
②写出硫酸亚铁高温分解反应的化学方程式________。
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该试验装置的措施____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法不正确的是( )
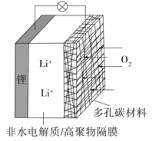
A.放电时,多孔碳材料电极为正极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向锂电极迁移
D.充电时,电池总反应为Li2O2-x=2Li+ (1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2,每生成3mol KH(IO3)2,反应中转移的电子数为___,向反应后溶液中加_______溶液得到KIO3。

(2)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式__________。
②电解过程中通过阳离子交换膜的离子主要为_____,其迁移方向是_______(用A、B表示)。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有_______(写出一点)。
(3)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加____盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为_________。
(4)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量____mgkg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究欲利用甲烷消除NO2污染,CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。

下列说法正确的是
A.①组中,0~20min内,用NO2表示的反应速率为0.0125mol·Lˉ1·minˉ1
B.由实验数据可知实验控制的温度T1<T2
C.容器内混合气体的密度不变,说明反应已达到平衡状态
D.若增大压强,则正反应速率加快,逆反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向如图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.X和Y可能是

A | B | C | D | |
X | NO2 | SO2 | HCl | Cl2 |
Y | 饱和NaOH溶液 | 饱和碳酸氢钠溶液 | 亚硫酸钠溶液 | 亚硫酸钠溶液 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com