
X、Y、Z、T、W五种元素的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)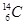 或
或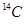 (1分);1s22s22p63s23p63d54s1或[Ar]3d54s1(2分)
(1分);1s22s22p63s23p63d54s1或[Ar]3d54s1(2分)
(2)Cl(2分);B、D(2分)
(3)1:1(或1)(2分);分子晶体(1分);Y的氢化物分子间存在氢键(2分)
(4)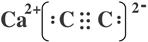 (2分);sp(1分)
(2分);sp(1分)
解析试题分析:X原子的最外层电子数是次外层电子数的2倍,由于最外层电子数最多是8个,因此X只能是第二周期元素,则X是碳元素。Y常温下单质为双原子分子,其氢化物水溶液呈碱性,则Y应该是氮元素。Z基态原子最外层电子排布式为(n+1)sn(n+1)pn2,s只能容纳2个电子,所以n=1,则最外层电子数=2+2×2=6,属于第三周期元素,则Z是S元素。T与Z同周期,元素最高价是+7价,因此是第ⅦA族元素,则T是Cl元素。W原子序数为Y、T元素之和,则原子序数=7+17=24,属于W是Cr元素,不锈钢中含有该元素。
(1)碳元素X的一种同位素可测定文物年代,这种同位素的符号是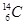 或
或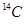 ;根据构造原理可知,Cr元素基态原子电子排布式1s22s22p63s23p63d54s1或[Ar]3d54s1。
;根据构造原理可知,Cr元素基态原子电子排布式1s22s22p63s23p63d54s1或[Ar]3d54s1。
(2)Z与T分别是S与Cl,属于第三周期元素。同周期自左向右非金属性逐渐增强,所以非金属性是氯元素的强于S元素的。A、非金属性强弱与非金属单质的状态无关系,所以常温下Z的单质和T的单质状态不同不能说明非金属性强弱,A不正确;B、非金属性越强,氢化物的稳定性越强,因此T的氢化物比Z的氢化物稳定,可以说明氯元素的非金属性强于硫元素的,B正确;C、一定条件下Z和T的单质都能与氢氧化钠溶液反应不能说明二者的非金属性强弱,C不正确;D、非金属性越强。电负性越大。因此T的电负性比Z大可以说明氯元素的非金属性强于硫元素的,D正确,答案选BD。
(3)CS2分子的结构与CO2相似,含有碳硫双键。由于单键都是σ键,双键是由1个σ键与1个π键构成的,所以该分子中σ键与π键个数比为1:1。该化合物在常温下是液态,因此形成的晶体是分子晶体。由于氨气分子间存在氢键,所以易液化。
(4)原子数与价电子数分别都相等的是等电子体,则与CO互为等电子体的阴离子是C22-,与钙离子形成的离子化合物是CaC2,其电子式为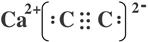 。由于三键是直线型结构,所以碳原子的杂化轨道类型是sp杂化。
。由于三键是直线型结构,所以碳原子的杂化轨道类型是sp杂化。
考点:考查核外电子排布、元素组成;非金属性强弱比较;共价键和氢键;等电子体的应用以及电子式的书写等


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的原子结构示意图为 。
(2)0.1 mol/L A的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子
方程式为 。
(3)以A的单质和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的化学方程式是 。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。
化合物甲能与水缓慢反应生成含B的化合物乙,乙分子中含有10个电子。写出该
反应的化学方程式: 。
工业用A的单质和化合物乙在高于1700K反应制备甲。已知该反应可以认为是置
换反应,该反应的化学方程式是 。
(5)D和E两种元素相比较,非金属性较强的是(填元素名称) ,可以验证该结论的是(填写编号) ;
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)C、D、E间可形成丙、丁两种分子,它们均含有18个电子,则丙与丁反应生成D单质的化学方程式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________;M在元素周期表中的位置为____________;
⑵ Z、X两元素按原子数目比2∶4构成分子则其结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下:
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
其中表示生成1 mol硒化氢反应热的是__________(填字母代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素。常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体。C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
(1)D元素在周期表中的位置是: 周期 族。
(2)A与C形成的18电子分子的结构式为: 。
(3)最近意大利罗马大学的Funvio Cacace等人获得了极具理论研究意义的B4分子。B4分子结构如图所示,已知断裂l molB-B吸收167kJ热量,生成1 mo1B2放出942kJ热量。根据以上信息和数据,下列说法正确的是 。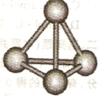
A.B4沸点比P4(白磷)低,属于原子晶体
B.l molB4气体转变为B2吸收882kJ热量
C.B4与B2互为同素异形体
D.B4与B2分子中各原子最外电子层均达到8电子稳定结构
(4)写出过量的F与稀硝酸反应的离子方程式
(5)以D为阳极,在H2SO4溶液中电解,D表面形成氧化膜,阳极电极反应式为 。
(6)在常温,常压和光照条件下,B2在催化剂(TiO2)表面与A2C反应,生成1molBA3(g)和C2时的能量变化值为382.5kJ,此反应BA3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| BA3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式 。
(2)用电子排布图表示F元素原子的价电子构型 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为 。
(4)离子半径D+ B3—,第一电离能B C,电负性C F
(填“<”、“>”或“=”)。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1∶1,X的电子式为 ,试写出Cu、稀H2SO4与X反应制备硫酸铜的离子方程式 。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(4)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: ,其原子核外有 种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 (用元素符号表示)。
(2)ZYQ的电子式是_______________。
(3)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素可组成多种分子,其空间构型可能是 (填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(5)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1︰1,请你仅用一个化学方程式表示甲既有氧化性又有还原性:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列是三个不同短周期部分元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com