
| A. | 40mL 1 mol•L-1的稀硝酸溶液 | B. | 40mL 0.5 mol•L-1的稀硫酸溶液 | ||
| C. | 40mL 1 mol•L-1的FeCl3溶液 | D. | 60mL 0.5 mol•L-1的稀盐酸 |
分析 A.看作一次性加入80mL 1mol/L 稀硝酸,根据关系式3Cu~8HNO3计算判断;
B.由3Cu+8H++2NO3-=3Cu2++2NO+4H2O,可知0.03mol完全溶解,应满足0.08molH+ 和0.02molNO3-;
C.根据方程式计算稀硝酸溶解Cu的物质的量,可得剩余Cu的物质的量,再计算0.04molFe3+ 能溶解Cu的物质的量进行判断;
D.结合B中的分析计算判断.
解答 解:n(Cu)=1.92g÷64g•mol-1=0.03moL,40mL 1mol/L 稀硝酸中n(HNO3)=0.04L×1 mol/L=0.04mol,
A.80mL 1mol/L 稀硝酸中n(HNO3)=0.08L×1 mol/L=0.08mol,根据关系式3Cu~8HNO3可知,溶解Cu为0.08mol×$\frac{3}{8}$=0.03mol,所以铜全部溶解,故A不选;
B.由3Cu+8H++2NO3-=3Cu2++2NO+4H2O,可知0.03mol完全溶解,应满足0.08molH+ 和0.02molNO3-,而实际n(H+ )=2×0.04L×0.5mol/L+0.04L×1 mol/L=0.08 mol,n(NO3-)=n(HNO3)=0.04mol,故铜全部溶解,故B不选;
C.根据关系式3Cu~8HNO3可知,溶解Cu为0.04mol×$\frac{3}{8}$=0.015mol,剩余Cu为0.03mol-0.015mol=0.015mol,而n(Fe3+)=0.04L×1mol/L=0.04mol,由2Fe3++Cu=2Fe2++Cu2+,可知0.04molFe3+ 能溶解0.02molCu,故Cu能完全溶解,故C不选;
D.0.03mol完全溶解应满足0.08molH+ 和0.02molNO3-,而实际n(H+ )=0.06L×0.5mol/L+0.04L×1 mol/L=0.07 mol,提供H+ 少于0.08mol,不足,铜不能溶解,故D选.
故选:D.
点评 本题考查混合物计算、硝酸性质等,题目涉及过量计算问题,注意利用离子方程式计算,熟练掌握元素化合物性质,题目具有一定的难度.


科目:高中化学 来源: 题型:选择题
| A. | 23 | B. | 55 | C. | 78 | D. | 133 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
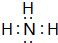 ,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.
,A和D按原子数1:1形成的化合物的结构式为H-O-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-→CaCO3↓ | |
| B. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O→3I2+6OH- | |
| C. | 向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气:2Fe2++4Br-+3Cl2→2 Fe3++2Br2+6Cl- | |
| D. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O→AgOH↓?+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCH4中含有氢原子数目为4NA | |
| B. | 1 molNa2O2中含有的阴离子和阳离子的数目为2NA | |
| C. | 0.1 mol/LCu(NO3)2溶液中含有的离子数目为0.2NA | |
| D. | 28 gN2中所含的原子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com