
【题目】DBFC燃料电池的结构如图,该电池的总反应为NaBH4+4H2O2=NaBO2+6H2O。下列关于电池工作时的相关分析不正确的是( )
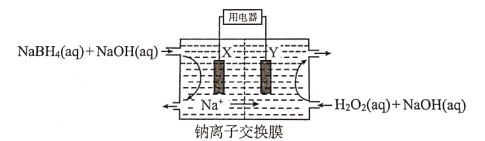
A.X极为正极,电流经X流向外电路
B.Y极发生的还原反应为H2O2+2e-=2OH
C.X极区溶液的pH逐渐减小
D.每消耗1.0L0.50mol/L的H2O2电路中转移1.0mole-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
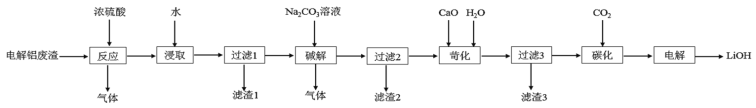
(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
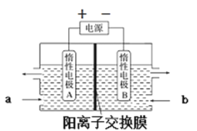
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。
(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料,而氢气、二甲醚等都是很有发展前景的新能源。
(1)在25℃、101kPa时,1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则表示甲烷燃烧热的热化学方程式是___________________________________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ· mol-1,已知CO气体燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-565.14 kJ·mol-1,试计算相同物质的量的C3H8和CO燃烧产生的热量的比值________(保留小数点后一位)。
(3)氢气既能与氮气发生反应又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1
3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1
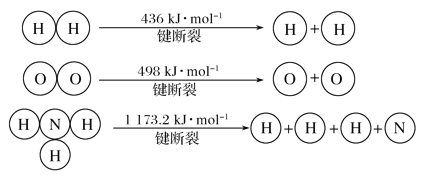
计算断裂1 mol N≡N键需要消耗能量________kJ。
(4)由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.1 kJ· mol-1
②CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH2=-49.0 kJ· mol-1
水煤气变换反应:③CO(g)+H2O(g)===CO2(g)+H2(g) ΔH3=-41.1 kJ· mol
二甲醚合成反应:④2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ· mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某无色溶液中只含有下列7种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-,已知该溶液与铝反应放出氢气,若反应后生成AlO2-,则溶液中一定存在的离子有______________,一定不存在的离子有______________,可能存在的离子有__________________,该溶液与铝反应放出氢气的离子方程式为_____________________________________。
(2)铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,某兴趣小组首先将其制成水溶液。
①通常将氢氧化钠溶液加入氯化亚铁溶液的实验现象是___,
②书写氢氧化亚铁在空气中转化为氢氧化铁的化学方程式___。
(3)在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是___。试解释原因:___。有同学提出加入CuO以除去Fe3+。你认为理由是___。
(4)能不能直接蒸发CuCl2溶液得到CuCl2·2H2O晶体?___(填“能”或“不能”)。若能,不用回答;若不能,说明理由___。
(5)将FeCl3固体溶于蒸馏水配制溶液时常会出现浑浊,得不到澄清的氯化铁溶液,其原因是___,如果要得到澄清的氯化铁溶液,可采取的措施是___。
(6)泡沫灭火器使用NaHCO3和Al(SO4)3溶液反应产生CO2来灭火。试从平衡移动的角度分析以上两种溶液反应产生CO2的原因:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学,如:①硫酸亚铁片用于治疗贫血(如图是其说明书),②复方氢氧化铝用于治疗胃酸过多,③明矾用作净水剂,等等。

阅读上方“硫酸亚铁片”的标签说明,回答:
(1)“鉴别”中,“加稀盐酸1滴”的作用是___;不是加稀硫酸的原因是_____。
(2)复方氢氧化铝治疗胃酸过多时,氢氧化铝作为___(填“酸”或“碱”)中和过多胃酸;氢氧化铝也能跟烧碱溶液反应,反应的离子方程式为_____。
(3)明矾能净水是因为①Al3+能水解,②水解产物氢氧化铝具有____能力。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知偶氮化合物茜草黄(![]() )是常用植物染色剂和消炎类药物,其一种合成路线如图:
)是常用植物染色剂和消炎类药物,其一种合成路线如图:
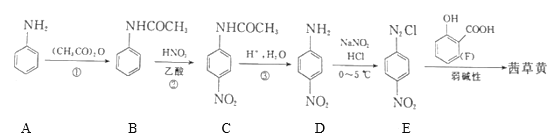
(1)茜草黄中含氧官能团的名称为___,E的分子式为___。
(2)已知A的系统名称为苯胺,则D的名称为___,①的反应类型为___;写出反应②的化学方程式:___。
(3)1molC与NaOH溶液混合,最多消耗___molNaOH;已知一NH2和一OH对苯环有相似的影响作用,请写出A遇浓溴水发生的化学反应方程式为___。
(4)写出符合下列条件的F的所有同分异构体:___,其中核磁共振氢谱吸收峰最少的有___种。
①芳香族类化合物;②在酸或碱性环境下均可水解;③可以和甲醛发生缩聚反应
(5)参照上述合成路线,设计一条以对甲基苯胺和苯酚及必要试剂合成偶氮化合物![]() 的路线:___。
的路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在抗击新冠肺炎的过程中,科研人员研究了法匹拉韦、利巴韦林、氯硝柳胺等药物的疗效,三种药物主要成分的结构简式如下。下列说法不正确的是
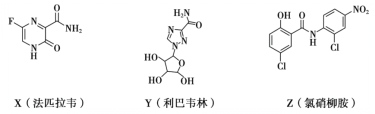
A.X的分子式为C5H4O2N3F
B.Z中含有6种官能团
C.Y和Z都有羟基,但性质不完全相同
D.X和Z都能发生加成反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com