
一定条件下,在2L的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)⇌2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到前2min末时,容器中n(SO2)为( )
|
| A. | 1.6mol | B. | 1.2mol | C. | 大于1.6mol | D. | 小于1.2mol |
考点:
化学平衡的计算.
专题:
计算题;化学平衡专题.
分析:
依据化学反应速率的概念进行分析计算,并注意浓度越大,反应速率越大来解答.
解答:
解:根据化学反应速率的概念可知,进行到4min时,测得n (SO2)=0.4mol,此时反应的速率为V(SO2)=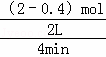 =0.2mol/L•min;反应进行到前2min末时设二氧化硫物质的量为x,依据速率定义可得V′(SO2)=
=0.2mol/L•min;反应进行到前2min末时设二氧化硫物质的量为x,依据速率定义可得V′(SO2)=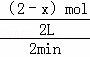 ;进行到2min时的物质浓度大于4min时的物质的浓度,所以反应时4min的反应速率小于2min的反应速率,即V′(SO2)=
;进行到2min时的物质浓度大于4min时的物质的浓度,所以反应时4min的反应速率小于2min的反应速率,即V′(SO2)=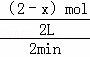 >0.2mol/L•min;整理得,x<1.2mol;
>0.2mol/L•min;整理得,x<1.2mol;
故选D.
点评:
本题考查了化学反应速率的概念应用,化学反应速率的影响因素,主要是浓度对速率的影响判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=﹣4b kJ/mol
B. C2H2(g)+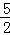 O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
O2(g)═2CO2(g)+H2O(l);△H=2b kJ/mol
C. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=2b kJ/mol
D. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l);△H=b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学与环境的叙述不正确的是()
A. 航天飞机上的隔离陶瓷属于复合材料
B. CO2和NO2是造成酸雨的主要原因
C. 燃煤中加入适量石灰石,可减少废气中SO2的含量
D. 垃圾是放错地方的资源,应分类回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
日常生活中使用的铝合金中的铝来自于电解氧化铝.工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为Si02、Fe2O3、Ca0、Mg0、Na20等.工业生产铝锭的工艺流程示意图如下:
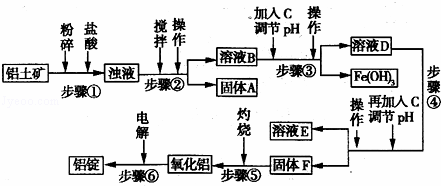
一些氢氧化物沉淀的pH如表:
沉淀物 Al(OH)3 Fe(OH)3 Mg(OH)2
开始沉淀pH(离子初始浓度为0.01mol/L) 4 2.3 10.4
完全沉淀pH(离子初始浓度为<10﹣5mol/L) 5.2 4.1 12.4
请回答下列问题:
(1)实验室进行步骤④的操作名称为 .
(2)固体A的化学式为 ,物质C的化学式为 .
(3)步骤④调节pH的范围为 .
(4)步骤⑥反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于小苏打水溶液的表述正确的是( )
|
| A. | c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3) |
|
| B. | c(Na+)+c(H+)=c(HCO3﹣)+c(CO32﹣)+c(OH﹣) |
|
| C. | HCO3﹣的电离程度大于HCO3﹣的水解程度 |
|
| D. | 存在的电离有:NaHCO3═Na++HCO3﹣,HCO3﹣═H++CO32﹣,H2O⇌H++OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH﹣离子浓度分别为Amol•L﹣1与Bmol•L﹣1,则A和B的关系为( )
|
| A. | A>B | B. | A=10﹣4B | C. | B=10﹣4A | D. | A=B |
查看答案和解析>>
科目:高中化学 来源: 题型:
国际无机化学命名委员会在1989年曾经建议,把长式周期表原先的主、副族及族号取消,从左到右改为第1~18列,第ⅠA族为第1列,稀有气体元素为第18列.按这个规定,下列说法不正确的是( )
|
| A. | 第15列元素的最高价氧化物为R2O5 |
|
| B. | 第2列元素中肯定没有非金属元素 |
|
| C. | 第17列元素的第一种元素无含氧酸 |
|
| D. | 第16、17列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所选装置不合理的是()
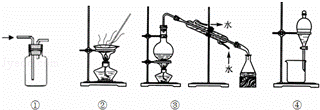
A. 用排空气法收集NH3,选① B. 从食盐水中获得食盐,选②
C. 用自来水制取蒸馏水,选③ D. 用CC14提取碘水中的碘,选④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com