
| a |
| a+2 |
| b |
| b+32 |
| a |
| a+2 |
| b |
| b+32 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、除去Mg粉中的Al粉:加入足量NaOH溶液后,过滤、洗涤 |
| B、除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤 |
| C、除去NaHCO3溶液中Na2CO3:加适量稀盐酸 |
| D、除去Fe2O3中的少量Al2O3:加入过量氢氧化钠溶液,过滤,洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,I途径的反应速率和Ⅱ途径的反应速率相同 |
| B、达平衡时,体系内混合气体的平均密度相同 |
| C、I、Ⅱ两途径达到平衡时,体系内混合气体的百分组成相同 |
| D、I、Ⅱ两途径达到平衡时,体系内混合气体的平均相对分子质量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| B、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| C、c(CH3COO- )+c(CH3COOH)=0.1 mol/L |
| D、c(Na+)>c(CH3COO-)>c (H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
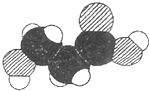
| A、分子中可能含有羟基 |
| B、分子中可能含有羧基 |
| C、该物质的分子式可能为C3H6O3 |
| D、分子中可能含有氨基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释后两溶液的pH相等 |
| B、稀释后甲瓶溶液的pH一定小于乙溶液 |
| C、稀释后甲瓶溶液的pH小于或等于乙溶液 |
| D、稀释后甲瓶溶液的pH一定大于乙溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com