
 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题: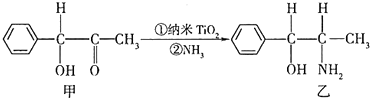
分析 (1)质子数相同、中子数不同的相同元素不同原子互为同位素;根据其价电子数及能层数确定在元素周期表中的位置,Ti元素核外有22个电子,根据构造原理书写其基态原子核外电子排布式;
(2)利用均摊法确定其化学式;
(3)采取sp3杂化的原子价层电子对数是4,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于相邻元素;
(4)根据配合物的结构特点来分析其中的化学键以及配体情况.
解答 解:(1)2248Ti和2250Ti为质子数相同中子数不同的钛元素的不同原子,互称同位素,
故答案为:同位素;
(2)该化合物中,O原子个数=12×$\frac{1}{4}$,Ti原子个数=8×$\frac{1}{8}$,Ba原子个数为1,所以其化学式为:BaTiO3,
故答案为:BaTiO3;
(3)采取sp3杂化的原子价层电子对数是4,价层电子对个数是4的原子有:连接甲基和羟基的碳原子、氧原子和氮原子,同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于相邻元素,所以这三种元素第一电离能从大到小顺序是:N>O>C,
故答案为:N>O>C;
(4)配离子[TiCl(H2O)5]2+中含有非金属原子之间的极性共价键以及配位键,钛元素的配位体是H2O、Cl-,
故答案为:极性共价键、配位键;H2O、Cl-.
点评 本题考查物质结构和性质,涉及晶胞的计算、原子的杂化方式、第一电离能大小的判断、基态原子核外电子排布式的书写等知识点,这些都是高考热点,会利用价层电子对互斥理论确定原子的杂化方式、第一电离能的规律、构造原理来分析解答.


科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗2n molSO2的同时生成2n molS03,说明该反应达到平衡状态 | |
| B. | 达到化学平衡时,SO2、02和SO3的物质的量浓度均保持不变 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,SO2将完全转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④② | B. | ②④①②③ | C. | ④②③①② | D. | ②④②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
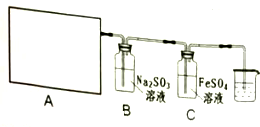
| 实验目的 | 操作与结论 |
| ①FeSO4溶液完全未被氧化 | 实验①取少许溶液于试管中,滴入数滴KSCN溶液,若溶液不变色(选填“不变色”或“变红色”),说明溶液完全未被氧化. |
| ②FeSO4部分被氧化 | ②实验②:取少许溶液于试管中,滴入数滴酸性KMnO4溶液,若溶液褪色;再另取少许溶液于试管中,滴加几滴KSCN溶液,溶液变 红(血红)色,说明溶液被部分氧化. |
| ③FeSO4完全被氧化 | ③重复实验②在待测②液中滴加数滴酸性KMnO4溶液后,溶液不褪色,另一实验现象与②同. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
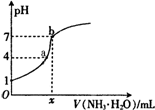 向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )| A. | x=20 | B. | 稀H2SO4的浓度为0.10mol/L | ||
| C. | b点有:2c(NH4+)=c(SO42-)>c(H+)=c(OH-) | D. | a点有:c(NH4+)<2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:
(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.这两个过程的热化学方程式为:| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com