
含氮化合物对人类生活有十分重大的意义。
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合。
已知:N2(g)+O2(g) =2NO(g) △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
①写出工业合成氨的热化学方程式: 。
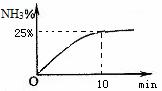 ②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。
②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为 ;达平衡时,N2的转化率为 。
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将 ,平衡常数 (填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法。据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质。进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ | 30 | 40 | 50 |
| NH3生成量/10-6mol | 4.8 | 5.9 | 6.0 |
①写出常温下“人工固氮”反应的化学方程式: _
此反应△H 0(填“>”、“<”或“=)。
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。写出TiCl4水解的化学方程式: 。
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是 。
A.适当升高温度 B.将氨气液化分离
C.增大反应物N2的浓度 D.增大压强
科目:高中化学 来源: 题型:
在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如右图,则下列叙述正确的是
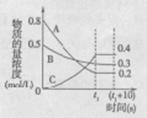
A.该反应的化学方程式为A+3B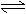
 2C
2C
B.在tl s时,v(A)正=0
C.(t1+l0)s时再充入0.4 molA和0.25 mol B,反应物A的转化率增大
D.若该反应在绝热容器中进行,也在tl时刻达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的数值,下列叙述正确的是
A.常温下,1mol丙烯中含碳原子数为3NA
B.常温下,pH=13的 NaOH溶液中含OH-数为NA
C.标准状况下,22.4LCHCl3中含C-H键数为NA
D.23g Na与足量氧气反应时转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,将等体积的盐酸和氨水混和后,所得溶液的pH=7,则下列说法正确的是 ( )
A. 原来盐酸的物质的量浓度等于氨水的物质的量浓度
B. 所得溶液中c(NH4+)=c(Cl—)
C. 所得溶液中c(NH4+)+c(H+)=c(Cl—)
D. 所得溶液中c(NH4+)+c(NH3·H2O)=c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应:A+B===C,下列条件的改变一定能使化学反应速率加快的是( )
A.增加A的物质的量 B.升高体系的温度
C.增加体系的压强 D.减少C的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法不正确的是 ( )
A.化学反应达到最大限度时,正逆反应速率也达到最大且相等
B.催化剂能降低化学反应的活化能,加快反应速率,提高生产效率
C.用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率
D.用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快
查看答案和解析>>
科目:高中化学 来源: 题型:
在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO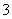 +5SO
+5SO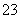 +2H+===I2+5SO
+2H+===I2+5SO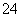 +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| 实验序号 | 0.01 mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1 Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间 |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
该实验的目的是________;表中V2=________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42- 含量较高,必须添加钡试剂除去SO42- ,该钡试剂可以是______________(填字母代号)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。
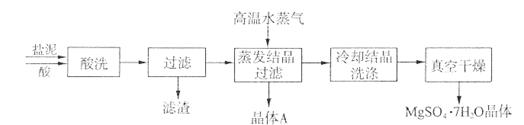
回答下列问题:
①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因 。
②过滤所得滤渣的主要成分为 。
③根据下图分析,蒸发结晶过滤所得晶体A主要成分为 。
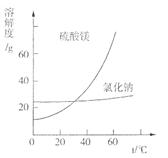
④真空干燥MgSO4·7H2O晶体的原因是 。
(3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com