
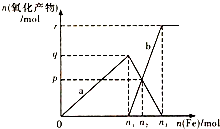
 含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )
含有4molHNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示.下列有关判断不正确的是( )| A. | a是Fe(NO3)3 | B. | n1=1 | C. | p=1.2 | D. | n3=1.5 |
分析 向稀硝酸中加入铁粉时,开始先生成Fe(NO3)3,当铁过量时,过量的铁再与 Fe(NO3)3反应生成 Fe(NO3)2,反应涉及两个方程式Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O、:2Fe(NO3)3+Fe=3 Fe(NO3)2,由此分析解答.
解答 解:(1)向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为4mol利用方程式可计算出生成的 Fe(NO3)3为1mol,所以参加反应的铁为1mol即n1=1,a为 Fe(NO3)3,故AB错误;
(2)Fe(NO3)3 与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,设又加铁物质的量xmol,则利用方程式可求得3x=1-2x,解之得x=0.2mol,所以n2=1+0.2=1.2,即p=0.6,所以n3=1.5,故D错误;
故选C.
点评 本题考查了铁与稀硝酸的反应,要注意铁和硝酸谁多谁少,以及加入的顺序,题目难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
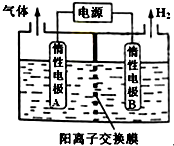 利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )
利用LiOH可制备锂离子电池正极材料.LiOH可由电解法制备,如图,两极区电解质溶液分别为LiOH和LiCl溶液.下列说法错误的是( )| A. | B极区电解质溶液为LiOH溶液 | |
| B. | 阳极电极反应式为2Cl--2e-═Cl2↑ | |
| C. | 电解过程中主要是H+通过阳离子交换膜向B电极迁移 | |
| D. | 电极A连接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s)$\stackrel{△}{→}$Na2CO3(s) | B. | CuCl2$\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{葡萄糖}$Cu | ||
| C. | Al$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{△}{→}$NaAlO2(s) | D. | MgO(s)$\stackrel{HNO_{3}(aq)}{→}$Mg(NO3)2(aq)$\stackrel{电解}{→}$Mg(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | Y>Z>X | D. | Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
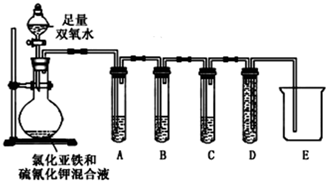
| 实验过程和象限 | 结论 |
| (2)试管A中盛有品红溶液;现象: 品红溶液褪色 | 证明气体中含有SO2 |
| (2)试管B中现象紫色酸性高锰酸钾溶液颜色不变或变浅 ;试管C中现象现象:澄清石灰水变浑浊 | 证明气体中含有CO2 |
| 实验过程 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
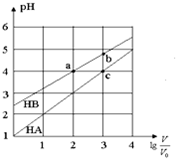 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| C. | 溶液中水的电离程度:a=c>b | |
| D. | 当$lg\frac{V}{V_0}=3$时,若两溶液同时升高温度,则$\frac{{c({B^-})}}{{c({A^-})}}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
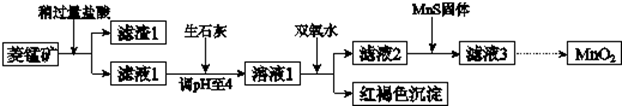
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com