
| A | B | C | D |
带玻璃塞的试剂瓶 | 聚乙烯盒 | 铁罐车 | 铝制饭盒 |
| 可用于盛放氢氧化钠溶液 | 可用于盛装食品 | 可用于运输浓硫酸 | 不宜长时间存放酸性或碱性的食物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.玻璃的成分中含有二氧化硅,二氧化硅是酸性氧化物,能和强碱反应,生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住;
B.根据聚乙烯无毒判断;
C.铁在冷的浓硫酸中发生钝化;
D.根据铝及其氧化铝的两性判断.
解答 解:A.氢氧化钠呈强碱性,能和二氧化硅反应生成硅酸钠,硅酸钠具有黏性,能把玻璃塞黏住,所以不能用带玻璃塞的试剂瓶存放氢氧化钠溶液,故A错误;
B.因为聚乙烯无毒,所以可以用来盛放食品,故B正确;
C.用铁制容器盛放和运输浓硫酸,是因为铁在冷的浓硫酸中发生钝化,故C正确;
D.因为铝及其氧化铝具有两性,即能与酸反应又能与强碱反应,所以铝制饭盒不宜长时间存放酸性或碱性的食物,故D正确.
故选A.
点评 本题考查物质的基本性质,注意根据铝的两性、铁的钝化、以及氢氧化钠溶液不能用带玻璃塞的试剂瓶保存来判断是关键,本题难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅是良好的半导体材料 | |
| B. | 硅单质可用来制造太阳能电池 | |
| C. | SiO2是制造光导纤维的材料 | |
| D. | 可用带玻璃塞的试剂瓶中盛有NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
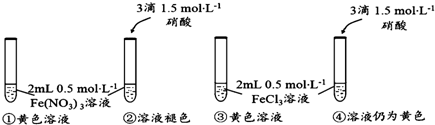

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42ˉ恰好完全反应:2Ba2++4OH-+Al3++2SO42-→BaSO4↓+AlO2-+2H2O | |
| C. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O→2HCO3- | |
| D. | 向Fe2(SO4)3溶液中加入过量Na2S溶液:2Fe3++3S2-→2FeS↓+S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+ | |
| B. | 硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- | |
| C. | 氯水具有漂白性:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | X分别与Z、W形成化合物的熔点:Z<W | D. | 简单离子的还原性:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NO3-、Cl-、K+ | B. | K+、Ba2+、OH-、SO42- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Cu2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
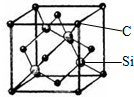 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com