
分析 将0.1mol/L盐酸溶液和0.12mol/L氢氧化钠溶液等体积混合,NaOH过量,根据混合后溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$,然后根据溶液中的c(H+)=$\frac{Kw}{c(O{H}^{-})}$来计算出氢离子浓度,并根据溶液的pH=-lgc(H+)计算.
解答 解:将0.1mol/L盐酸溶液和0.12mol/L氢氧化钠溶液等体积混合,NaOH过量,则混合后溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.12mol/L×V-0.1mol/L×V}{2V}$=0.01mol/L,故溶液中的c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,则溶液的pH=-lgc(H+)=12.
答:混合后溶液的pH为12.
点评 本题考查了酸碱混合后溶液pH的计算,题目难度中等,明确判断酸碱混合的定性判断及pH的计算方法为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:实验题
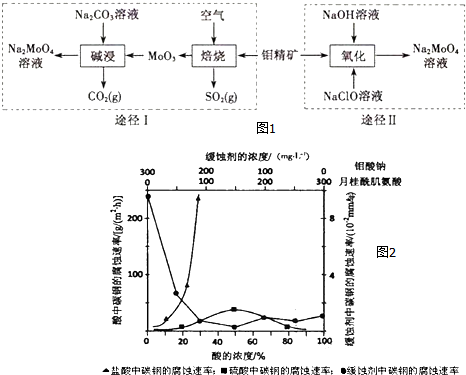
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑨ | B. | ①②④⑨ | C. | ③⑤⑥⑧ | D. | ①②③④⑤⑥⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
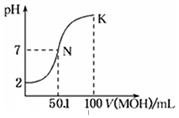 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中,不正确的是( )| A. | HA的电离方程式为:HA=H++A- | |
| B. | MOH为一元弱碱 | |
| C. | K点对应的溶液中有:c(MOH)+c(M+)=0.02mol•L-1 | |
| D. | N点对应的溶液中有:c(M+)=c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无 | B. | ①②⑤ | C. | ①②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物 质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③⑦⑧⑥ | B. | ②③⑦⑤⑥ | C. | ①③⑧⑥⑦ | D. | ②⑥③⑦⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com