
【题目】龙胆酸烷基酯类F是一种药物皮肤美白剂,合成路线如下:
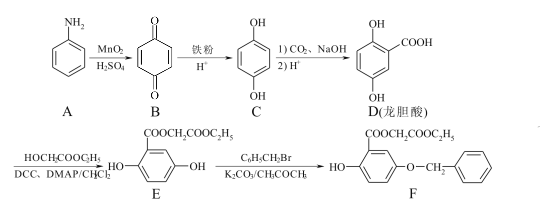
(1)D(龙胆酸)中含氧官能团的名称为 、 。
(2)E →F的反应类型是 。
(3)写出D →E反应的化学方程式: 。
(4)写出满足下列条件的龙胆酸乙酯(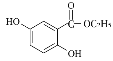 )的一种同分异构体结构简式: 。
)的一种同分异构体结构简式: 。
Ⅰ.能发生银镜反应,与FeCl3不发生显色反应但其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有四组峰,且峰的面积之比为6:2:1:1。
(5)已知: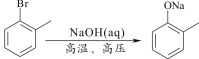 。水杨酸乙酯(
。水杨酸乙酯(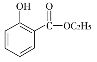 )广泛应用于日用香皂等。根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)广泛应用于日用香皂等。根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]()
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】下列物质之间的相互关系不正确的是
A. 热稳定性:HCl>HI
B. O2和O3互为同素异形体
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3
D. 干冰和冰为同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应的认识正确的是
A.化学反应过程中,一定有化学键的断裂和形成
B.日常生活中的废旧电池会污染环境,所以应集中填埋处理
C.化学反应过程中,分子的种类和数目一定发生改变
D.放热反应的反应速率,一定比吸热反应的反应速率快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题
Ⅰ.实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)Na2SO3溶液在空气中存放,容易被氧化成 (填化学式)。
检验是否存在该杂质的方法是: 。
(2)操作X的名称为 。
(3)通入Cl2发生反应的离子方程式 。
(4)含碘废液中加入稍过量的Na2SO3溶液,Na2SO3将废液中的I2还原为I-,这样做的目的是 。
Ⅱ.亚硫酸钠溶液中加入过量的碘酸钾酸性溶液,反应的化学方程式为(未配平):
Na2SO3+KIO3+H2SO4→Na2SO4+K2SO4+I2+H2O。回答下列问题:
(1)若反应中有5 mole- 转移,则生成碘是 mol。
(2)该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+SO32-→IO―+SO42-(快)
③IO―+SO32-→I―+SO42-(快)
④5I―+6H++IO3-→3I2+3H2O(快)
⑤I2+SO32-+H2O→2I-+SO42-+2H2(快)
由上述条件推测,此反应的总的反应速率由第 步反应决定(填序号)。
(3)若预先加入淀粉溶液,由题述看,必须在 离子消耗完时,蓝色现象才会产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成原电池问题。
Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2 mol/L H2SO4 溶液中,乙同学将电极放入2 mol/L的NaOH溶液中,如图所示。
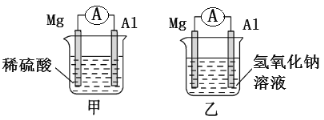
请回答:
(1)写出甲池中正极的电极反应式: 。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极: ;
总反应: 。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出______ 活动性更强,而乙会判断出______ 活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?_________(填写字母序号)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.上述实验反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”的做法是“不可靠”的
Ⅱ.市场上出售的“热敷袋”其主要成分是铁屑、炭粉、木屑和少量氯化钠、水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。“热敷袋”放出的热量是利用了 而放出热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下:
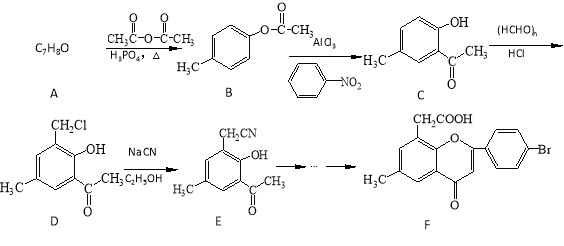
![]() 已知:RCN在酸性条件下发生水解反应:
已知:RCN在酸性条件下发生水解反应:![]()
(1)已知A转化为B的同时还生成了乙酸,则A的结构简式为 ,该反应类型是 。
(2)C的分子式为 。
(3)F分子中有3个含氧官能团,名称分别为醚键、 和 。
(4)写出B与过量氢氧化钠水溶液反应的化学方程式(不必注明反应条件): 。
(5)写出两个符合下列条件的C的同分异构体的结构简式 、 。
①能与NaHCO3反应生成CO2 ②苯环上有两种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化银在溶液中有极微量的电离:AgCl(s)![]() Ag+(aq)+Cl-(aq)。不能说明该电离达到平衡状态的是
Ag+(aq)+Cl-(aq)。不能说明该电离达到平衡状态的是
A.Ag+的浓度不再改变
B.Ag+的生成速率和Ag+、Cl- 结合生成AgCl的速率相等
C.AgCl的质量不再减少
D.Ag+与Cl- 的物质的量比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏四氯乙烷是一种常见化工原料,以偏四氯乙烷和烯烃(C5H10)为原料合成某种六元环酯(C7H10O4)的合成路线如下:
已知:一个碳原子上连接2个—OH不稳定,容易脱水变成![]()
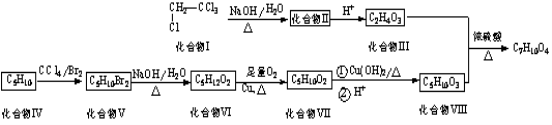
(1)化合物II中能与能与金属钠反应的官能团名称为 。
(2)化合物IV合成化合物V的反应类型为 ,化合物V合成化合物VI反应类型为 。
(3)写出由化合物VI合成化合物VII的反应方程式 。
(4)有机物R是化合物IV的同分异构体,R能使溴水褪色,且其核磁共振氢谱中有4组峰,有机物R的结构简式为 ,该六元环酯(C7H10O4)的结构简式为 。
(5)参照上合成路线,设计以有机物(![]() )和乙二醇为原料合成聚乙二酸乙二醇酯的合成路线。
)和乙二醇为原料合成聚乙二酸乙二醇酯的合成路线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g。求原气体混合物中乙烯与乙烷的物质的量之比和质量比。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com