
| A. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| B. | 制造新版人民币所使用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| C. | 为了增强漂白粉的使用效果,在使用漂白粉时必须和盐酸混合使用 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程对青蒿素的提取属于物理变化 |
分析 A.合金的硬度大于其任一成分;
B.棉花、优质针叶木主要成分是纤维素;
C.次氯酸根离子能够氧化盐酸生成氯气;
D.屠呦呦对青蒿素的提取为萃取过程.
解答 解:A.剑刃硬度要大,剂钢指的是铁的合金制成,剂钢指的是铁的合金,故A正确;
B.棉花、优质针叶木等原料的主要成分是纤维素,故B正确;
C.次氯酸根离子能够氧化盐酸生成氯气,氯气有毒,所以使用漂白粉不能与盐酸一起使用,故C错误;
D.屠呦呦对青蒿素的提取为萃取过程,没有新物质生成,属于物理变化,故D正确;
故选:C.
点评 本题考查了生活、生产中的化学知识,涉及合金的概念、漂白粉漂白原理、物理变化与化学变化区别,侧重基础知识的考查,题目难度不大,


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
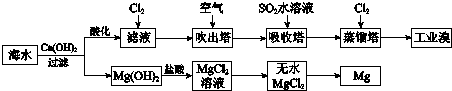
| A. | 工业上常利用电解熔融MgCl2冶炼金属镁 | |
| B. | 工业上可用NaBr溶液除去溴中含有的少量Cl2 | |
| C. | 富集溴元素过程中,空气吹出法利用了溴易挥发的性质 | |
| D. | 若提取1 mol Br2,至少需要标准状况下22.4 L的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 【有机化学基础】
【有机化学基础】 出发来合成M,路线如下:
出发来合成M,路线如下: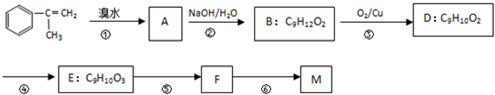
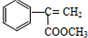 .
.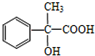 .
. +Br2→
+Br2→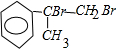 ;
;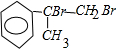 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$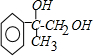 +2NaBr;
+2NaBr;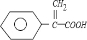 +CH3OH $→_{△}^{浓H_{2}SO_{4}}$
+CH3OH $→_{△}^{浓H_{2}SO_{4}}$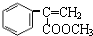 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
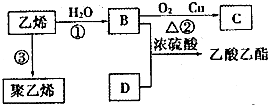
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
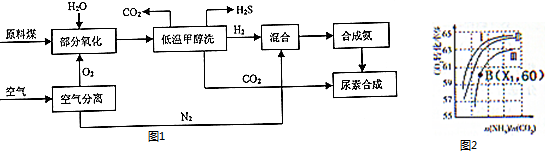
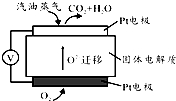 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | 常温下用0.10 mol/L NaOH溶液分别滴定盐酸和醋酸溶液,以HA表示酸,当达到滴定终点时,两溶液中均存在c(Na+)=c(A-) | |
| C. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) | |
| D. | 1 mol冰醋酸和1mol乙醇在浓硫酸、加热条件下充分反应生成的水分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com