
| A、0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 | ||
B、将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的
| ||
| C、相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 | ||
| D、若HA、HB均为弱酸,酸性HA>HB,则相同条件下,溶液的pH大小为NaA>NaB |
| 1 |
| 2 |


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期元素的离子中W离子半径最小 |
| B、元素X能与元素Y形成共价化合物X2Y2 |
| C、工业上用二氧化锰和浓盐酸制取Q的单质 |
| D、元素Z、W、R的最高价氧化物对应的水化物之间均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、相同条件下,pH=5的 ①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③ |
| C、NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |
| D、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝与稀盐酸反应:Al2O3+6H+=2Al3++3H2O |
| B、氯化铵溶液与氢氧化钠溶液共热:NH4++OH-═NH3?H2O |
| C、碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
| D、硫酸亚铁溶液中加双氧水:Fe2++2H2O2+4 H+=Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
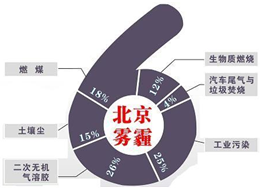 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
| ||
| ||
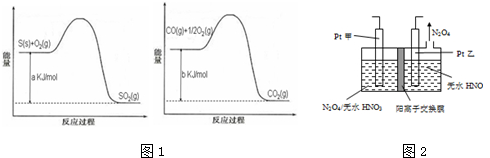
| 催化剂 |
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 依据叙述,写出下列反应的热化学方程式.
依据叙述,写出下列反应的热化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质(25℃) | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | ≥6.4 | ≥9.6 | ≥3~4 |
A、混合溶液中:c(SO
| ||
| B、若向混合溶液中加入铁粉,不可能观察到红色固体析出 | ||
| C、若向混合溶液中加入足量氯水,调节pH到3-4后过滤,得到纯净的CuSO4溶液 | ||
| D、若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(0H)3沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com