
A.戊烷 B.丁烷 C.丙烷 D.乙烷
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
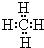

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.

| 0.082 |
| 0.06×0.182 |
| 0.082 |
| 0.06×0.182 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)?PCl5(g).5min末达到平衡,有关数据如下表:
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com