
| A. | 天平所配的砖码有脏污 | |
| B. | 药品保存不善,露置时间过长 | |
| C. | 定容时液面与容量瓶壁交界处到达刻度就定容完毕 | |
| D. | 溶解步骤完成后,洗涤次数过多 |
分析 结合c=$\frac{n}{v}$可知,V偏大或n偏小,则导致所配溶液浓度偏高,以此来解答.
解答 A.天平所配的砝码有脏污,将导致所称物体质量减轻,n=$\frac{m}{M}$即物质的量减小,根据c=$\frac{n}{v}$可得,配制的溶液浓度偏低,故A正确;
B.药品露置时间过长,导致NH4HCO3分解,将导致称取的质量偏大,n=$\frac{m}{M}$即物质的量增大,根据c=$\frac{n}{v}$可得,配制的溶液浓度偏高,故B错误;
C.定容时液面与容量瓶壁交界处到达刻度就定容完毕,操作正确,不会带来误差,故C错误;
D.溶解步骤完成后,洗涤次数过多,耗时太长将会导致NH4HCO3发生双水解,NH4HCO3溶物质的量减小,根据c=$\frac{n}{v}$可得,配制的溶液浓度偏低,故D正确;
故选AD.
点评 本题考查了配制一定物质的量浓度的溶液中的误差分析,题目难度不大,注意掌握配制一定浓度的溶液方法,明确误差分析的方法与技巧,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 5倍 | B. | 4倍 | C. | 3 倍 | D. | 2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
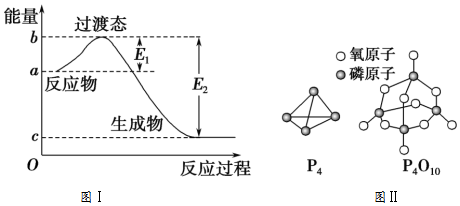
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/(kJ/mol) | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol/L的FeCl3溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1 NA | |
| B. | 7.8 gNa2O2中含有的离子总数目为0.4 NA | |
| C. | 标准状况下,44.8 L HF所含分子数为2 NA | |
| D. | 标准状况下,80 gSO3中所含的原子数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
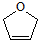 是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( )
是一种有机烯醚,可由链烃A通过下列路线制得,下列说法正确的是( )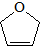
| A. | B中含有的官能团有溴原子、碳碳双键 | |
| B. | A的结构简式是CH2═CHCH2CH3 | |
| C. | 该有机烯醚不能发生加聚反应 | |
| D. | ①②③的反应类型分别为加成反应、取代反应、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
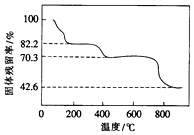 硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.
硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.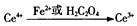
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | 古代文献 | 说明 | |
| A | 使用 | 《周礼》:“煤饼烧蛎房(牡蛎壳)成灰”,蔡伦造纸用此“灰”溶于水沤浸树皮脱胶. | “灰”的主要成分是氧化钙 |
| B | 鉴别 | 《新修本草》:硝石“如握盐雪不冰,强烧之,紫青烟起”,用于区分硝石(KNO3)和朴硝(Na2SO4) | 利用颜色反应 |
| C | 浸出 | 《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”. | 提取青蒿素中的纤维素 |
| D | 性质 | 《本草纲目》:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧机诸药者”. | 利用KNO3的氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)═10-7mol•L-l | |
| B. | 常温下pH=2的盐酸和pH=12的氨水等体积混合后c(C1-)+c(H+)═c(NH4+)+c(OH-) | |
| C. | 常温下0.1 mol•L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)=10 -10 mol•L-l | |
| D. | 常温下向10 mL0.1 mol•L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$将减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com