
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数增大 | D. | A的转化率降低 |
分析 mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到$\frac{1}{2}$,若平衡不移动,C的浓度为原来的2倍,当达到平衡时C的浓度为原来的1.9倍,则体积减小时平衡逆向移动,以此来解答.
解答 解:mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到$\frac{1}{2}$,若平衡不移动,C的浓度为原来的2倍,当达到平衡时C的浓度为原来的1.9倍,则体积减小时平衡逆向移动,
A.体积缩小,相当于加压,平衡逆向移动,则m+n<p,故A正确;
B.由上述分析可知,平衡逆向移动,故B正确;
C.平衡逆向移动,C的体积分数减小,但比原来的大,故C错误;
D.平衡逆向移动,A的转化率降低,故D正确;
故选C.
点评 本题考查影响平衡移动的因素,注意把握“体积压缩到$\frac{1}{2}$,当达到平衡时C的浓度为原来的1.9倍”为解答的关键信息,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度℃ | 400 | 500 | 830 | 1000 |
| 平均常数K | 10 | 9 | 1 | 0.6 |
| A. | 上述反应中正反应是吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{\{c({H}_{2})•c(C{O}_{2})\}}{\{c(CO)•c({H}_{2}O)\}}$ | |
| C. | 该反应在400℃时达平衡状态,若升高温度,则正反应速率减小,逆反应速率增大 | |
| D. | 在830℃,2L的密闭容器中,冲入1molCO、5molH2O(g)、3molCO2和2molH2发生上述反应,在达到平衡前V(正)<V(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制催化剂的材料 | B. | 耐高温、耐腐蚀的合金材料 | ||
| C. | 半导体材料 | D. | 制农药的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:C2H4 | |
| B. | S2-的结构示意图: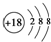 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | NH4Cl的电子式为: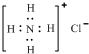 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO32-和Br-浓度都会减小 | B. | 溶液颜色会发生变化 | ||
| C. | 该过程中不会有沉淀生成 | D. | 离子浓度基本保持不变的只有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
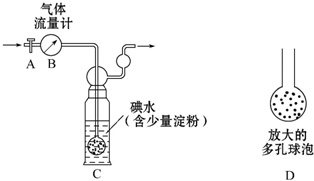
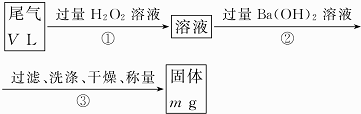
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
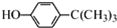 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: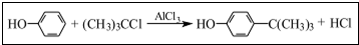 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.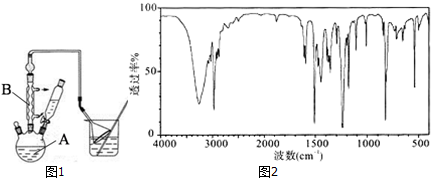
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大O2的浓度能加快反应速率 | B. | 降低体系温度能加快反应速率 | ||
| C. | 使用催化剂不影响反应速率 | D. | 一定条件下SO2能100%转化为SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com