
分析 (1)脱水过程中反应放热,所生产的碳和浓硫酸反应生成二氧化硫、二氧化碳和水;
(2)反应过程中表现了浓硫酸的脱水性生成碳,强氧化性和碳反应生成人欲横流和二氧化碳、水;
(3)产生的有刺激性气味的气体为二氧化硫,通入品红溶液中褪色,是二氧化硫的漂白性;产生的有刺激性气味的气体二氧化硫也可使溴水褪色.表现了二氧化硫的还原性,可以被溴单质氧化为硫酸.
解答 解:(1)黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是二氧化硫,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑,故答案为:SO2,C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+2SO2↑;
(2)将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质碳表现了浓硫酸的脱水性,黑色物质继续与浓硫酸作用会产生两种气体,体现了浓硫酸的强氧化性,过程中为表现酸性和脱水性,故答案为:BCD;
(3)有刺激性气味的气体通入品红溶液中,可以看到品红溶液褪色,表现了二氧化硫的漂白性,二氧化硫和溴水反应生成硫酸,反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr,
故答案为:褪色;漂白;SO2+Br2+2H2O=H2SO4+2HBr.
点评 本题考查了浓硫酸性质的分析判断,性质应用,蔗糖脱水过程中的反应 分析产物判断,实验验证,题目较简单.


科目:高中化学 来源: 题型:填空题
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 单质 | 氧化物 | 混合物 | 胶体 | 电解质 | 非电解质 |
| 属于该类的物质 | ② | ④ | ⑧⑨ | ⑦ | ③⑤⑥ | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
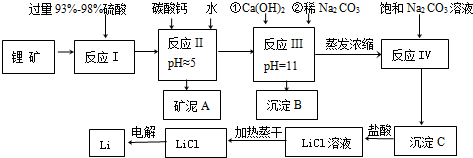
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液 | |
| B. | 金属钠与水的反应实质上是与水电离产生的H+反应 | |
| C. | 将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中 | |
| D. | 做有关钠的性质实验时,剩余的Na不用放回原试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 4:1 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
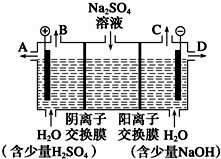 天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀盐酸混合:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 硫酸铜溶液与烧碱溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 碳酸氢钠与稀盐酸混合:HCO3-+H+═CO2↑+H2O | |
| D. | 把二氧化碳通入氯化钙溶液中:Ca2++H2O+CO2═CaCO3↓+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com