
| A. | 同一反应中,氧化剂失电子的总数一定等于还原剂得电子的总数 | |
| B. | 氧化剂在反应中被还原,生成氧化产物 | |
| C. | 氧化还原反应的特征是有化合价的升降 | |
| D. | 任何反应中一定有氧化剂和还原剂,且氧化剂和还原剂必须为不同种物质 |
分析 A.氧化剂得电子,还原剂失电子;
B.氧化剂被还原,得到还原产物;
C.氧化还原反应中元素的化合价会发生变化;
D.非氧化还原反应中没有氧化剂和还原剂.
解答 解:A.氧化还原反应中电子守恒,则还原剂失去电子总数一定等于氧化剂得到电子总数,故A错误;
B.氧化剂在反应中得电子被还原,生成还原产物,故B错误;
C.氧化还原反应的实质是电子的转移,其特征是化合价的升降,故C正确;
D.非氧化还原反应中没有氧化剂和还原剂,氧化还原反应中存在氧化剂和还原剂,氧化剂和还原剂可以为同种物质,故D错误;
故选C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重基本概念的考查,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2 NA | |
| B. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| D. | 标准状况下,0.1NA的SO3的体积约为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的组成元素中都有C、H、O、N等元素 | |
| B. | 在一定条件下,它们都能发生水解反应 | |
| C. | 人体需要的二十多种氨基酸都可以通过人体自身合成 | |
| D. | 油脂分为油和脂肪,它们都是高级脂肪酸的甘油酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 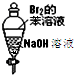 振荡后静置,溶液不再分层,且保持无色透明 | |
| B. |  铁片最终完全溶解,且高锰酸钾溶液变无色 | |
| C. |  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内出现红棕色气体 | |
| D. |  当溶液至红褐色,停止加热,液体变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH值等于14与pH值等于12的两种NaOH溶液等体积混和后,c(H+)=$\frac{1{0}^{-14}+1{0}^{-10}}{2}$ | |
| B. | 常温下,浓度为1×10-10mol/L的KOH溶液的pH值最接近于4 | |
| C. | 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 | |
| D. | 常温下,相同温度下pH值等于1的盐酸溶液中水的电离程度与pH值等于13的Ba(OH)2溶液中水的电离程度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
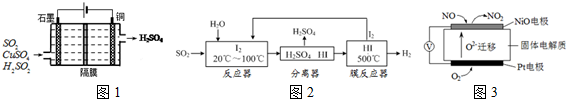
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com