
下列化学式中,表示正长石(KALSI3O8)的是
A、K2O?Al2O3?3SiO2 B、K2O?2Al2O3?3SiO2
C、K2O?2Al2O3?6SiO2 D、2K2O?2Al2O3?6SiO2
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正化合价是+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
 ,下列说法正确的是
,下列说法正确的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
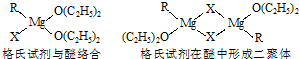
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
A.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4![]() HBr+NaHSO4 ①
HBr+NaHSO4 ①
R-OH+HBr![]() R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br―被浓硫酸氧化为Br2等。有关数据列表如下;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g?cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是
。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,起目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键
(II)(14分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
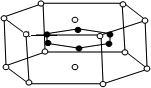
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com