
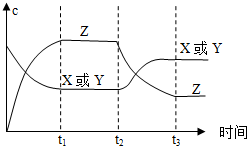
 已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )| A. | 升高温度 | B. | 减小Z的浓度 | C. | 增大压强 | D. | 增大X或Y的浓度 |
分析 从t2秒后X或Y的浓度增大,Z的浓度减小,说明平衡向逆反应方向移动,根据反应的特点和外界条件对平衡的影响来判断.
解答 解:A、该反应放热,升高该反应的温度,平衡逆向移动,X或Y的浓度增大,Z的浓度减小,图象符合,故A正确;
B、减小Z的浓度,平衡应正向移动,故B错误;
C、增大了体系压强,平衡不移动,X、Y、Z的浓度应增大,故C错误;
D、t2到t3X或Y的浓度增大,Z的浓度减小,若增大了X或Y的浓度,平衡向正反应方向移动,Z的浓度应增大,不符合,故D错误;
故选A.
点评 本题考查化学平衡的影响因素,题目难度不大,注意化学方程式的前后计量数的关系以及反应放热的特点,以此判断影响平衡移动的因素.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
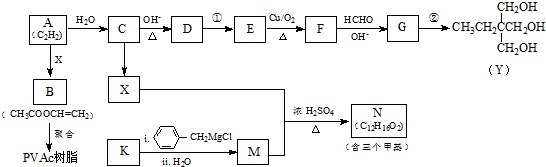
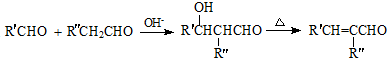
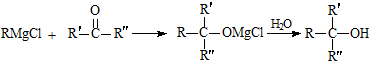
 .
. .
.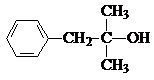 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每一个水分子内平均含有两个氢键 | |
| B. | 氢键与配位键一样,也是共价键的一种 | |
| C. | 氢键是导致浓硫酸具有粘稠性原因之一 | |
| D. | 由于H2O中含有氢键,因此水是一种非常稳定的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:K+>Mg2+>Na+ | |
| B. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | |
| C. | 结合H+的能力:OH->ClO->HCO3- | |
| D. | 相同pH的HCl和CH3COOH加水稀释相同倍数,pH:CH3COOH>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
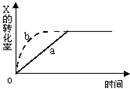 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )| A. | 增大体积 | B. | 增大Y的浓度 | C. | 缩小体积 | D. | 降低温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
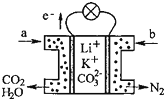 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )| A. | 此电池在常温时也能工作 | |
| B. | 正极电极反应式为:O2+2CO2+4e-=2CO32- | |
| C. | CO32-向正极移动 | |
| D. | a为CH4,b为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
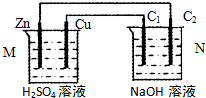
| A. | 工作一段时间后装置M、N中溶液pH均增大 | |
| B. | M装置中H+移向Zn电极 | |
| C. | C2上发生氧化反应 | |
| D. | Cu电极与C1电极发生的电极反应相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com