
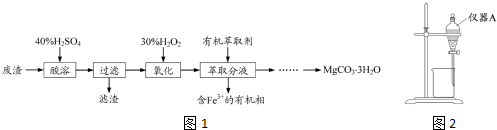
分析 废渣主要成分为MgCO3、MgSO4和少量Fe、Al的氧化物,加入40%的硫酸酸溶,过量后滤液中含有硫酸镁、硫酸亚铁、硫酸铝和过量的硫酸,加入H2O2氧化亚铁离子,然后加入有机萃取剂萃取Fe3+,分液后可除去溶液中的Fe3+,分液后水溶液中含有Mg2+、Al3+,可调节溶液pH至5<pH<8.5,可除去Al3+,又可防止生成Mg(OH)2,过滤后在滤液中加入碳酸钠溶液,可生成MgCO3沉淀,在50℃下干燥,得到MgCO3•3H2O.以此解答该题.
解答 解:废渣主要成分为MgCO3、MgSO4和少量Fe、Al的氧化物,加入40%的硫酸酸溶,过量后滤液中含有硫酸镁、硫酸亚铁、硫酸铝和过量的硫酸,加入H2O2氧化亚铁离子,然后加入有机萃取剂萃取Fe3+,分液后可除去溶液中的Fe3+,分液后水溶液中含有Mg2+、Al3+,可调节溶液pH至5<pH<8.5,可除去Al3+,又可防止生成Mg(OH)2,过滤后在滤液中加入碳酸钠溶液,可生成MgCO3沉淀,在50℃下干燥,得到MgCO3•3H2O.
(1)酸溶需加热的目的是加快反应(酸溶)速率;H2SO4不宜过量太多的避免制备MgCO3时消耗更多的碱;
故答案为:加快反应(酸溶)速率;避免制备MgCO3时消耗更多的碱;
(2)在酸性条件下,H2O2氧化亚铁离子为铁离子,本身被还原为水,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(3)①仪器A为分液漏斗;
故答案为:分液漏斗;
②萃取时,为使溶质尽可能被萃取,应充分振荡,以充分接触而分离;
故答案为:充分振荡;
(4)分液后水溶液中含有Mg2+、Al3+,可调节溶液pH至5<pH<8.5,可除去Al3+,又可防止生成Mg(OH)2,过滤后在滤液中加入碳酸钠溶液,可生成MgCO3沉淀,静置,向上层清夜中滴加碳酸钠溶液,若无沉淀生成,说明已完全反应,过滤后,用水洗涤固体2-3次,在50℃下干燥,得到MgCO3•3H2O;
故答案为:至5<pH<8.5,过滤,边搅拌边向滤液中滴加碳酸钠溶液至有大量沉淀生成,静置,向上层清夜中滴加碳酸钠溶液,若无沉淀生成.
点评 本题考查物质的制备及混合物分离和提纯,明确流程中的方法和基本操作、发生的化学反应是解答的关键,要求学生具有分析和解决问题的能力,题目有利于培养学生的实验能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 食用松花蛋时蘸些食醋可以去除氨味 | |
| B. | 用双氧水的稀溶液清洗伤口可以杀菌消毒 | |
| C. | 用淀粉溶液检验某食盐是否为加碘盐 | |
| D. | 长期使用含氟牙膏可预防龋齿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 世博会期间,利用可降解的“玉米翅料”替代一次性饭盒,可防止产生白色污染 | |
| B. | 世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 | |
| C. | 利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济” | |
| D. | 高纯度的硅单质广泛用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
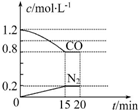 “霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.某地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
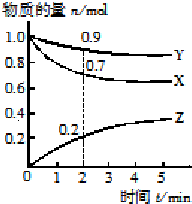 (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ④⑥ | C. | ②④⑦ | D. | ③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3═2H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3?Na++HCO3- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 g | B. | 3.45 g | C. | 1.15 g | D. | 0.575 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验设计 | 预期目的 | |
| A | 在相同温度下,分别取等质量的大理石块、大理石粉末分别与等体积等浓度的稀硫酸反应 | 探究反应物接触面积对化学反应速率的影响 |
| B | 把盛有颜色相同的NO2和N2O4的混合气体的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 将铁棒和石墨用导线连接后插入含有Fe2+、Cu2+的盐溶液中 | 探究Fe2+和Cu2+的氧化性相对强弱 |
| D | 相同温度下,向两支盛有等体积等浓度H2O2溶液的试管中分别滴入适量的CuSO4溶液和FeCl3溶液 | 探究不同催化剂对同一反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com