
在一定温度下,对于可逆反应C(s)+H2O(g)  CO(g)+H2(g),其平衡常数表达式正确的是( )
CO(g)+H2(g),其平衡常数表达式正确的是( )
A.K=[c(C)·c(H2O)]/ [c(CO)·c(H2)] B.K= [c(CO)·c(H2)]/ [c(C)·c(H2O)]
C.K=[c(H2O)]/ [c(CO)·c(H2)] D.K=[c(CO)·c(H2)/ [c(H2O)]]
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:
AmBnƒmAn++nBm-
在一定温度下,当c(An+)m×c(Bm-)n=Ksp时,溶液呈饱和状态,沉淀量既不增加,也不减少;当c(An+)m×c(Bm-)n>Ksp时,溶液呈过饱和状态,将析出沉淀;当c(An+)m×c(Bm-)<Ksp时,溶液呈不饱和状态,沉淀将溶解。
试根据上述原理,计算:
(1)已知在常温下,FeS的Ksp=6.25´10-18,求此温度下FeS的溶解度(g/100g水)。(设饱和溶液的密度为1g×mL-1)
(2)已知H2S饱和溶液在常温下,c(H+)与c(S2-)间存在着以下关系:c(H+)2×c(S2-)=1.0´10-22。在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)到达1mol×L-1,应调节溶液的pH为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:038
1998年南方发生洪涝灾害,群众饮水也成了大问题,因为洪水有多种病菌。为此有关部门调集大量漂白粉用于水的处理,在消毒时,加一点儿醋,消毒快效果好,这是为什么?
在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:
AmBnƒmAn++nBm-
在一定温度下,当c(An+)m×c(Bm-)n=Ksp时,溶液呈饱和状态,沉淀量既不增加,也不减少;当c(An+)m×c(Bm-)n>Ksp时,溶液呈过饱和状态,将析出沉淀;当c(An+)m×c(Bm-)<Ksp时,溶液呈不饱和状态,沉淀将溶解。
试根据上述原理,计算:
(1)已知在常温下,FeS的Ksp=6.25´10-18,求此温度下FeS的溶解度(g/100g水)。(设饱和溶液的密度为1g×mL-1)
(2)已知H2S饱和溶液在常温下,c(H+)与c(S2-)间存在着以下关系:c(H+)2×c(S2-)=1.0´10-22。在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)到达1mol×L-1,应调节溶液的pH为多少?
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:043
在一定温度下,对于难溶电解质AmBn,在水中可建立如下平衡:AmBn(固)![]() mAn++nBm-.
mAn++nBm-.
在一定温度下,当达到溶解平衡时,{c(An+)}m·{c(Bm-)}n为一常数,用Ksp表示,称为该温度下该难溶电解质的溶度积.在一定温度下,当{c(An+)}m·{c(Bm-)n=Ksp时,溶液呈饱和状态,沉淀质量既不增加,也不减少,当{c(An+)}m·{c(Bm-)}n>Ksp时,溶液呈过饱和状态,将析出沉淀;当{c(An+)}m·{c(Bm-)}n<Ksp时,溶液呈不饱和状态,沉淀将溶解.试根据上述原理,回答下面问题:
(1)已知在常温下FeS的Ksp=6.25×10-18,求此温度下FeS的溶解度(g/100 g水).(设饱和溶液的密度为1 g·mL-1)
(2)又知在常温下H2S饱和溶液中,c(H+)与c(S2-)间存在着以下关系:{c(H+)}2·c(S2-)=1.0×10-22.在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1 mol·L-1,应调节溶液的pH为多少?
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省高三第三次考试化学试卷(解析版) 题型:填空题
(11分)以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应I:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g)
△H = —49.0 kJ·mol-1
反应II:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
△H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g)
△H = —173.6 kJ·mol-1
(1)写出由CH3CH2OH +_____ 2CH3OH的热化学方程式为:__________________。
2CH3OH的热化学方程式为:__________________。
(2)在一定条件下,对于反应I:在体积恒定的密闭容器中,达到平衡的标志是__ (填字母)
a.CO2和CH3OH 浓度相等 b.H2O的百分含量保持不变
c.H2的平均反应速率为0 d.v正(CO2)=3v逆(H2)
e.混合气体的密度不再发生改变
f. 混合气体的平均相对分子质量不再发生改变
如果平衡常数K值变大,该反应 (填字母)
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是 (填字母) ,
达到平衡后,想提高H2转化率的是_______________(填字母)
a、降低温度 b、补充H2 c、移去甲醇 d、加入催化剂
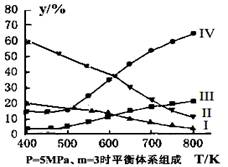
(3)在密闭容器中,对于反应II中,研究员以生产乙醇为研究对象,在5MPa、m= n(H2)/n(CO2)=3时,测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示,则表示CH3CH2OH体积分数曲线的是 ;表示CO2的体积分数曲线的是 。
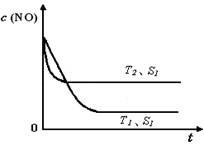
(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。上图是反应:2NO(g)
+ 2CO(g)
 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线, 若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线, 若催化剂的表面积S1>S2 ,在上图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com