
【题目】按要求回答问题
(1)KAl(SO4)2的电离方程式_______________________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是______________、_________________ (填微粒符号)。
(3)实验室用质量分数为36.5%,密度为1.19g·cm-3的浓盐酸来配制100ml,2mol/L的稀盐酸,需要用量筒量取_______________ml该浓盐酸。
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况) SO2时,转移的电子是__________mol。
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
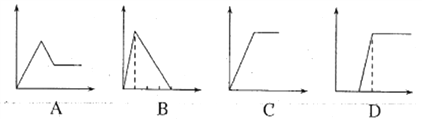
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | ___ |
【答案】 KAl(SO4)2 = K++ Al3++2SO42- H+ HClO 16.8 0.4 C D B
【解析】试题分析:(1)KAl(SO4)2在水中电离为K+、 Al3+、SO42-;氯气与水反应生成盐酸和次氯酸,盐酸使石蕊变红、次氯酸具有漂白性使石蕊褪色;(3)根据稀释前后溶质物质的量不变计算配制100ml 2mol/L的稀盐酸需要浓盐酸的体积;(4)根据氧化还原反应的归中规律,H2SO4被还原为SO2;H2S被氧化为S。(5)AlCl3溶液通入过量的NH3,生成氢氧化铝和氯化铵; Na2CO3和NaOH的溶液,滴入过量的盐酸,依次发生的反应是![]() 、
、![]() 、
、![]() ;NaAlO2溶液滴加稀硫酸至过量,依次发生的反应是
;NaAlO2溶液滴加稀硫酸至过量,依次发生的反应是![]() 、
、![]() ;
;
解析:(1)KAl(SO4)2在水中电离为K+、 Al3+、SO42-,电离方程式是KAl(SO4)2 = K++ Al3++2SO42-;氯气与水反应生成盐酸和次氯酸,盐酸使石蕊变红、次氯酸具有漂白性使石蕊褪色,使溶液变红和褪色的微粒分别是H+、 HClO;(3)质量分数为36.5%,密度为1.19g·cm-3的浓盐酸的物质的量浓度是![]() ,设需要浓盐酸的体积是VL, 根据稀释前后溶质物质的量不变,
,设需要浓盐酸的体积是VL, 根据稀释前后溶质物质的量不变, ![]() ,V=0.0168L=16.8mL;(4)根据氧化还原反应的归中规律,H2SO4被还原为SO2;H2S被氧化为S,所以当生成4.48L(标况)SO2时,转移的电子是
,V=0.0168L=16.8mL;(4)根据氧化还原反应的归中规律,H2SO4被还原为SO2;H2S被氧化为S,所以当生成4.48L(标况)SO2时,转移的电子是![]() 。(5)AlCl3溶液通入过量的NH3,生成氢氧化铝和氯化铵,符合图像是C; Na2CO3和NaOH的溶液,滴入过量的盐酸,依次发生的反应是
。(5)AlCl3溶液通入过量的NH3,生成氢氧化铝和氯化铵,符合图像是C; Na2CO3和NaOH的溶液,滴入过量的盐酸,依次发生的反应是![]() 、
、![]() 、
、![]() ,所以符合图像是D;NaAlO2溶液滴加稀硫酸至过量,依次发生的反应是
,所以符合图像是D;NaAlO2溶液滴加稀硫酸至过量,依次发生的反应是![]() 、
、![]() ,所以符合图像是B。
,所以符合图像是B。


科目:高中化学 来源: 题型:
【题目】取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,下列有关说法正确的是
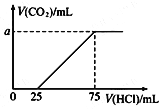
A. 原溶液中NaOH的物质的量为0.75 mol
B. 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C. 通入CO2后所得的溶液中含有2.5×10-3 mol NaHCO3
D. 纵坐标中a的数值为224
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学设计了以下三组实验验证某无色溶液中含有的离子:
①溶液  直接观察无明显的紫色火焰:证明没有K+
直接观察无明显的紫色火焰:证明没有K+
②溶液 ![]()
 产生白色沉淀:证明有SO42-
产生白色沉淀:证明有SO42-
③溶液  白色沉淀
白色沉淀  无色溶液
无色溶液  白色沉淀:证明有Al3+下列说法正确的是( )
白色沉淀:证明有Al3+下列说法正确的是( )
A.该无色溶液有可能是明矾溶液
B.这三组实验中,(2)和(3)都是严密合理的
C.步骤④的离子方程式为:Al3++3OH-=Al(OH)3↓
D.步骤⑥的化学方程式可能为:NaAlO2+2H2O +CO2= Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下: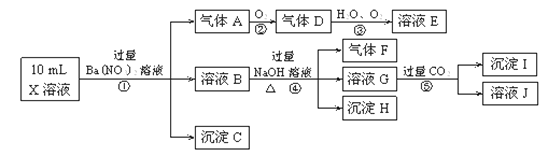
根据以上信息,回答下列问题:
(1)反应③的化学方程式为。
(2)沉淀C、H和气体F的化学式分别为。
(3)写出有关反应的离子方程式:
①中生成A。
⑤。
(4)上述离子中,溶液X中肯定不含有的离子是 , 可能含有的离子是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关锌-稀硫酸-铜构成的原电池的一些说法中,正确的是( )
A. 锌片为正极,且锌片逐渐溶解
B. 铜片为负极,且铜片上有气泡
C. 溶液中的H+移向铜极
D. 该电池工作的过程中溶液的酸性始终不变
【答案】C
【解析】A、较活泼的金属锌作负极,选项A错误;B、较活泼的金属锌作负极,较不活泼的金属铜作正极,正极上氢离子得电子生成氢气,所以铜片上有气泡生成,选项B错误;C、原电池中阳离子H+移向正极铜电极,选项C正确;D、负极上锌失电子生成锌离子进入溶液,正极上氢离子得电子生成氢气析出,所以一段时间后溶液中H+浓度降低,酸性减弱,选项D错误。答案选C。
【题型】单选题
【结束】
25
【题目】近几年科学家发明的一种新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( )

A. 石墨极发生的反应是2H2O+2e— === H2↑+2OH—
B. 有机电解质和水溶液不可以互换区域
C. 该装置不仅可提供电能,还可得到清洁的氢气
D. 标准状况下产生22.4 L的氢气时,正极消耗锂的质量为14 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( ) 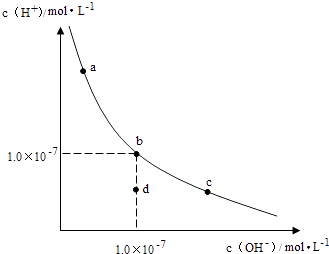
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置的说法不正确的是( ) 
A.装置①是原电池,装置②是电镀池
B.装置①中盐桥内的K+移向CuSO4溶液
C.装置①②铜极均发生氧化反应而溶解
D.装置②中的Cu2+浓度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com