
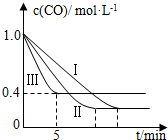
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
分析 (1)再根据盖斯定律来计算反应的焓变,根据热化学方程式的书写规律来书写热化学方程式;
(2)①由图表可知,曲线II和曲线I相比,平衡不移动,只是缩短了反应达平衡的时间,据此分析反应II的条件;
②由图象可知,CO的平衡浓度为0.4mol/L,即可知△c(CO)=0.6mol/L,根据反应速率的公式求算;
③CO的平衡浓度越大,则其平衡转化率越低;
④求出反应的浓度商Qc,与K做比较即可.
解答 解:(1)根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol,
故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=+163.9 kJ/mol;
(2)①由图表可知,曲线II和曲线I相比,平衡不移动,只是缩短了反应达平衡的时间,故II和I不同的条件为压强,且为增大压强,故Y为5MPa,两者的温度应相同,故X为530℃,故答案为:530;5;
②由图象可知,CO的平衡浓度为0.4mol/L,即可知△c(CO)=0.6mol/L,根据反应速率的公式V(CO)=$\frac{0.6mol/L}{5min}$=0.12mol•L-1•min-1.
故答案为:0.12;
③CO的平衡浓度越大,则其平衡转化率越低,故实验Ⅱ达平衡时CO的转化率大于实验Ⅲ达平衡时CO的转化率,故答案为:大于;
④若往1L容器中投入0.2mol CO(g)、0.2mol H2O(g)、1mol CO2(g)、0.1mol H2(g),则此时反应的浓度商Qc=$\frac{0.1mol/L×1mol/L}{0.2mol/L×0.2mol/L}$=2.5>K,则此时反应应向逆反应方向移动,故答案为:向逆方向.
点评 本题考查了盖斯定律的应用、影响化学反应速率和化学平衡的因素以及化学平衡常数的计算,综合性较强,难度适中.


科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、HCO3- | B. | NH4+、Al3+、SO42- | C. | Na+、AlO2-、NO3- | D. | Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N<Y<X<Z | B. | Y<X<N<M<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
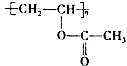
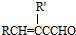 +H2O(R、R′表示烃基或氢),高分子化合物PVB的合成就是其一种重要应用.
+H2O(R、R′表示烃基或氢),高分子化合物PVB的合成就是其一种重要应用.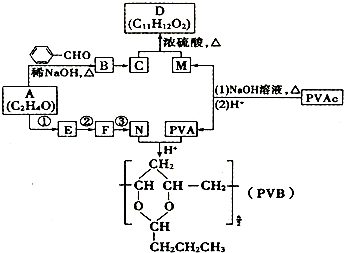

 合成B的化学方程式是
合成B的化学方程式是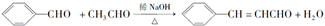 .
.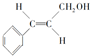 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应△H<0,△S<0,在任何条件下均可自发进行 | |
| B. | 新法合成氨不需要在高温条件下,可节约大量能源,极具发展远景 | |
| C. | 新法合成氨能在常温下进行是因为不需要断裂化学键 | |
| D. | 使用此新型催化剂能让该反应进行完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 涤纶、塑料、光导纤维都是有机高分子材料 | |
| B. | 煤经过气化或液化等物理变化可转化为清洁燃料 | |
| C. | 用电镀厂的废水直接灌溉农田,可提高水的利用率 | |
| D. | 工业燃煤中加入适量生石灰,可减少酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯分子中所有原子可能共平面 | |
| B. | 只有水就能区别苯、酒精、四氯化碳这三种无色液体 | |
| C. | 在化学反应过程中,发生物质变化的同时一定发生能量变化 | |
| D. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更难被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
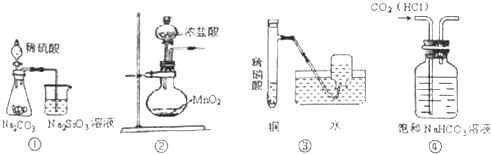
| A. | 图①可证明酸性强弱:H2SO4>H2CO3>H2SiO3 | |
| B. | 图②可用于实验室制备少量氯气 | |
| C. | 图③可用于实验室制备少量NO气体 | |
| D. | 图④可除去CO2中少量HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可使蛋白质变性,故可浸制标本 | |
| B. | 海水提取溴、煤的液化、纯碱去油污都发生了化学变化 | |
| C. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 | |
| D. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com