
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9,单质Y可与NaOH溶液反应生成氢气.下列说法不正确的是()
A. 原子半径:Y>Z>W
B. XW2熔点为107℃,沸点为142.5℃,说明固态XW2为分子晶体
C. 电解YW3固体可得单质Y
D. 
ZW2分子结构见右图,说明ZW2是极性分子
考点: 原子结构与元素的性质;原子结构与元素周期律的关系.
分析: X、Y、Z、W四种元素的原子序数依次增大,均为短周期元素,且互不同族,X原子的最外层电子数与次外层电子数相等,X只能有2个电子层,最外层电子数为2,则X为Be元素;X与W的最外层电子数之和均为9,则W最外层电子数为7,结合原子序数可知W为Cl,Y与Z这两对原子的最外层电子数之和均为9,结合原子序数可知,最外层电子数为3、6或4、5,且单质Y可与NaOH溶液反应生成氢气,则Y为Al,Z原子最外层电子数为6,故Z为S元素,据此解答.
解答: 解:X、Y、Z、W四种元素的原子序数依次增大,均为短周期元素,且互不同族,X原子的最外层电子数与次外层电子数相等,X只能有2个电子层,最外层电子数为2,则X为Be元素;X与W的最外层电子数之和均为9,则W最外层电子数为7,结合原子序数可知W为Cl,Y与Z这两对原子的最外层电子数之和均为9,结合原子序数可知,最外层电子数为3、6或4、5,且单质Y可与NaOH溶液反应生成氢气,则Y为Al,Z原子最外层电子数为6,故Z为S元素,
A.同周期随原子序数增大,原子半径减小,故原子半径Al>S>Cl,即Y>Z>W,故A正确;
B.BeCl2熔点为107℃,沸点为142.5℃,熔沸点很低,说明固态BeCl2为分子晶体,故B正确;
C.AlCl3属于分子晶体,熔融状态下不能导电,不能电解AlCl3制备Al,工业上通常采取电解熔融氧化铝冶炼Al,故C错误;
D.SCl2分子V形结构,分子中正负电荷重心不重合,SCl2是极性分子,故D正确,
故选C.
点评: 本题考查结构性质位置关系应用综合应用,涉及元素周期表、晶体类型与性质、分子结构等,推断元素是解题关键,需要学生具备扎实的基础,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法中不正确的是 ( )。
A.患口腔溃疡时我们可服用维生素B2,它存在于牛奶和蛋黄等食物中
B.多吃胡萝卜可预防夜盲症,因其中含有丰富的维生素A
C.维生素C具有止血功能,所以被称为抗坏血酸
D.维生素K是凝血酶元的主要成分,它是止血的功臣
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)。
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12 m) | 37 | 71 | 74 | 75 | 186 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
下列说法正确的是 ( )。
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.由X、Y、Z三种元素形成的化合物,其晶体一定是分子晶体
D.Y与W形成的化合物中,Y显负价
查看答案和解析>>
科目:高中化学 来源: 题型:
下列烷烃发生一氯取代后,能得到二种异构体的是()
A. CH3﹣CH(CH3)﹣CH(CH3)﹣CH3 B. CH3﹣C(CH3)2﹣CH2﹣CH3
C. (CH3CH2)3C﹣CH3 D. (CH3)3C﹣C(CH3)3
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2﹣和C﹣,B2+和C﹣具有相同的电子层结构,下列说法正确的是()
A. C元素的最高正价为+7价 B. 原子半径:A>B>C
C. 离子半径:A2﹣>C﹣>B2+ D. 还原性:A2﹣<C﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
有关短周期元素A、B、C、D、E、F的信息如下:
元素 有关信息
A 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐
B 最外层电子数是次外层电子数的2倍
C M层上有3个电子
D 短周期原子半径最大的主族元素
E 其单质是淡黄色固体
F 最高正价与最低负价代数和为6
请回答下列问题:
(1)写出基态A原子外围电子的电子排布图 .气态氢化物乙中A原子的杂化类型是SP3.
(2)E、F两元素的电负性大小比较:E F(选填>、<或=)
(3)下列说法正确的是 (填序号).
①实验室可用右图所示装置制取B的最高价氧化物.
②用C单质做成的槽车,都可用来运输甲的浓溶液.
③C形成的单质熔点低于D形成的单质的熔点.
④E的氢化物稳定性强于F的氢化物稳定性.
(4)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是 .
A.漂白剂B.氧化剂C.还原剂.

查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇、乙二酸、甘油三种物质分别与足量金属钠作用,生成等物质的量的H2,则乙醇、乙二酸、甘油物质的量之比为( )
|
| A. | 6:3:2 | B. | 1:2:3 | C. | 3:2:1 | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2﹣甲基﹣2﹣丁烯酸甲酯是一种重要的化工原料.下面是该物质的一种合成路线:
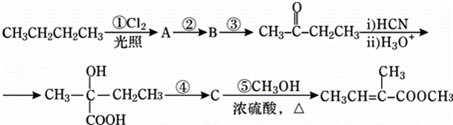
已知:R﹣CN R﹣COOH.
R﹣COOH.
请回答下列问题:
(1)A是一氯代烷,则其结构简式为 ;反应②的反应条件是 ;
(2)写出反应③的化学方程式: ;
(3)C的结构简式为 ,其所含官能团的名称是 ;
(4)步骤④的反应条件是 ,反应类型是 .
(5)2﹣甲基﹣2﹣丁烯酸甲酯的某种羧酸类链状同分异构体X,分子中含有3个甲基.则X的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液 显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com