
| A. | 5.6g铁与足量氯气完全反应时失去的电子数目为0.2NA | |
| B. | 标准状况下,11.2L H2中含有的电子数为1NA | |
| C. | 标准状况下,2.24 L水中含有水分子0.1 NA | |
| D. | 2L1mol/L的盐酸中所含氯化氢分子数为2NA |
分析 A.铁与氯气反应生成三氯化铁;
B.体积转化为物质的量结合氢气分子的结构解答;
C.气体摩尔体积Vm=22.4L/mol的使用对象为气体;
D.氯化氢为强电解质,在水中完全电离.
解答 解:A.铁与氯气反应生成氯化铁,5.6g铁与足量氯气完全反应时失去的电子数目为0.3NA,故A错误;
B.1个氢气分子含有2个电子,标准状况下,11.2L H2的物质的量为0.5mol,含有电子数为1NA,故B正确;
C.标况下,水为液体,不能使用气体摩尔体积,故C错误;
D.氯化氢为强电解质,在水中完全电离,盐酸中不存在氯化氢分子,故D错误;
故选:B.
点评 本题考查了物质的量的有关计算,注意气体摩尔体积的使用范围和条件是解题关键,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
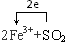
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H4 | C. | C3H4 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;②NH3的稳定性比PH3强(填写“强”或“弱”).
;②NH3的稳定性比PH3强(填写“强”或“弱”).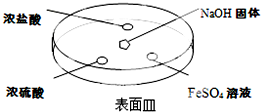
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有①③④ | C. | 只有①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易溶于水的电解质一定是强电解质,难溶于水的电解质一定是弱电解质 | |
| B. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| C. | NaCl溶液在电流的作用下电离成钠离子和氯离子 | |
| D. | 氯化钠晶体不导电是由于氯化钠晶体中不存在自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
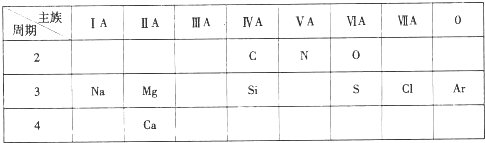
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
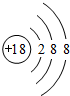
| A. | 原子核内质子数为19 | B. | 原子核外电子数为19 | ||
| C. | 质量数为40 | D. | 中子数为40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com