
【题目】在2L密闭容器内,800 ℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
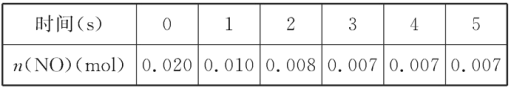
(1)上述反应____(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为________。
(2)如图中表示NO2变化曲线的是____。用O2表示从0s~2s内该反应的平均速率v=_______。
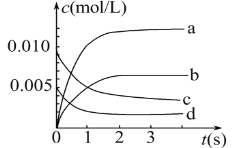
(3)能说明该反应已达到平衡状态的是_______。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v[(NO)逆]=2v[(O2)正] d.容器内密度保持不变
【答案】是 65% b 1.5×10-3 mol/(L·s) b、c
【解析】
(1)从图象分析,随反应时间的延长,NO的浓度不再不变,且没有完全反应;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量;
根据![]() 计算一氧化氮的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气的反应速率;
计算一氧化氮的反应速率,再结合同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比计算氧气的反应速率;
(3)平衡状态的实质为正反应速率等于逆反应速率,特征为各物质的浓度不变;
(1)从图象分析,随反应时间的延长,NO的浓度不再不变,且没有完全反应,说明反应达到了限度,反应为可逆反应。第5s时,NO的物质的量为0.007mol,则转化率![]() ;
;
(2)根据一氧化氮物质的量的变化知,该反应向正反应方向移动,则二氧化氮的物质的量在不断增大,且同一时间段内,一氧化氮减少的物质的量等于二氧化氮增加的物质的量,所以表示NO2的变化的曲线是b。0~2s内![]() ,同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为1.5×10-3 mol/(L·s);
,同一化学反应同一时间段内,各物质的反应速率之比等于其计量数之比,所以氧气的反应速率为1.5×10-3 mol/(L·s);
(3)a.虽然反应速率成系数比,但是无法判断正逆反应速率是否相等,a错误;b.压强之比等于物质的量之比,反应前后气体体积不同,压强不变,说明各物质的物质的量不变,反应达到平衡,b正确;c.v[(NO)逆]=2v[(O2)正],说明正逆反应速率相等,反应达到平衡状态,c正确;d.恒容容器,反应物生成物都是气体质量不变,所以密度不变,不一定平衡,d错误;答案为bc。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
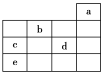
A. 元素b位于第ⅥA族,有+6、-2价两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c>d
D. 元素c和e的气态氢化物的稳定性:c>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:

(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”)
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
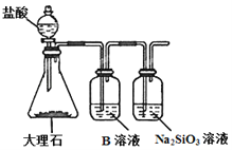
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成对国家工业发展有着举足轻重的作用,请根据化学原理知识回答下列问题:
(1)已知氢气的燃烧热为285.8kJ/mol。
4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
则工业合成氨的热化学方程式为________________。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验结果如图所示:(图中 T表示温度, n表示物质的量)
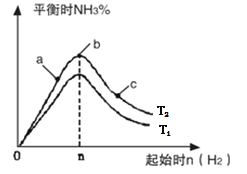
①图像中 T2和 T1的关系是: T2 _______________ T1(填“高于”、“低于”、 “等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N 2 的转化率最高的是_______________(填字母)。
③在起始体系中n(N2):n(H2)= 1:3时,反应后氨的百分含量最大;若容器容积为1L, n=3mol反应达到平衡时H2的转化率为60%,则此条件下( T 2),反应的平衡常数 K=__________________。
(3)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2![]() N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________
N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比, c(NO2)增大, c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)> v(逆)
(4)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
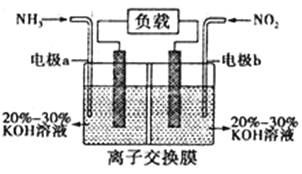
①电极a为___________________极,其电极反应式为__________________。
②当有0.1 mol NO2被处理时,转移电子为________________mol。
③为使电池持续放电,该离子交换膜需选用___________________交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢材料是当前新能源领域研究的一类热门材料。在一定条件下,以Cu-Zn原电池作电源,利用图所示装置可实现有机物的储氢,下列有关说法正确的是( )

A.在Cu-Zn原电池装置工作时,盐桥内的Cl-向铜电极一端移动
B.电极C为阳极,在电极D上发生还原反应
C.气体X的主要成分是H2
D.H+透过高分子膜从右室进入左室,在电极C上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种食品保鲜剂,可按如下途径合成:
 已知:RCHO+CH3CHO
已知:RCHO+CH3CHO![]() RCH(OH)CH2CHO。
RCH(OH)CH2CHO。
试回答:
(1)A的化学名称是_________,A→B的反应类型是_________。
(2)B→C反应的化学方程式为_____________________________。
(3)C→D所用试剂和反应条件分别是_____________。
(4)E的结构简式是______________。F中官能团的名称是________________。
(5)连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有______种。其中苯环上只有一个取代基,核磁共振氢谱有5个峰,峰面积比为2∶1∶2∶2∶1的同分异构体的结构简式为______________。
(6)写出用乙醇为原料制备2-丁烯醛的合成路线(其他试剂任选):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
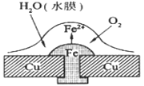
A. 此过程中铜并不被腐蚀
B. 此过程中正极电极反应式为:2H++2e- = H2↑
C. 此过程中电子从Fe移向Cu
D. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 7.8 g Na2S和Na2O2的混合物中含有的阴离子数为NA
B. 17 g H2O2含有0.5NA个非极性共价键
C. 常温下,56 g铁片投入足量浓H2SO4中产生H2分子的个数为NA
D. 标准状况下,22.4LCl2溶于水转移的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com