
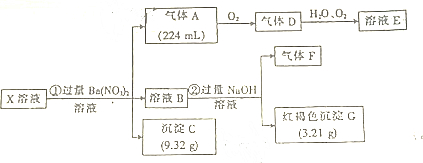
分析 加入过量硝酸钡生成沉淀,说明溶液中含有CO32-、SO32-、SO42-中的至少一种,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,一定含有H+,所以一定不含有CO32-、SO32-,溶液B中加入氢氧化钠产生红褐色的沉淀一定是氢氧化铁沉淀,铁离子可以是亚铁离子氧化来的,还可以原来溶液中存在铁离子,产生的气体一定是氨气,说明一定含有铵根离子.据此进行解答.
解答 解:加入过量硝酸钡生成沉淀,说明溶液中含有CO32-、SO32-、SO42-中的至少一种,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,产生的224mL气体是NO,物质的量是0.01mol,说明溶液中含有还原性离子,一定为Fe2+离子,一定含有H+,所以一定不含有CO32-、SO32-,溶液B中加入氢氧化钠产生红褐色的沉淀一定是氢氧化铁沉淀,沉淀的质量是3.21g,所以根据铁元素守恒,铁离子的物质的量是0.03mol,根据电子守恒,亚铁离子被硝酸氧化,得到0.01molNO,被氧化的亚铁离子物质的量是0.03mol,所以铁离子是亚铁离子氧化来的,一定不含铁离子,产生的气体一定是氨气,说明一定含有铵根离子,此外钾离子和氯离子是否存在无法判断.
(1)溶液中一定不存在的离子有:CO32-、SO32-,不能确定的离子有K+、Cl-,故答案为:CO32-、SO32-;K+、Cl-;
(2)写出反应②中生成的气体F是氨气,遇氯气产生白烟化学方程式为:3Cl2+8NH3═N2+6NH4Cl,故答案为:3Cl2+8NH3═N2+6NH4Cl;
(3)溶液含有氢离子,因为硝酸根离子、亚铁离子只有在酸性环境下才会发生反应生成铁离子以及一氧化氮气体,故答案为:存在;硝酸根离子、亚铁离子只有在酸性环境下才会发生反应生成铁离子以及一氧化氮气体.
点评 本题考查物质的检验与鉴别,属于中等难度的试题,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率,要依据物质的特殊性质和特征反应来判断、推理、验证.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,且通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |

| A. | B F | B. | A E | C. | B E | D. | A D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、NO3-、SO42-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b时:c(OH-)=c(H+)+c(HS-) | |
| B. | a=2b时:C(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) | |
| C. | a=2.5b时:C(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) | |
| D. | 若4c(Na+)=5c(S2-)+5c(HS-)+5c(H2S),a=3b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
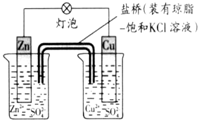
| A. | 正极反应为:Zn-2e-=Zn2+ | B. | Cu为负极,发生还原反应 | ||
| C. | 盐桥中的K+移向ZnSO4溶液 | D. | 在外电路中,电子从负极流向正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com