
对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)  H=+180.5kJ·mol-1;
H=+180.5kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)  H =-483.6 kJ·mol-1;
H =-483.6 kJ·mol-1;
N2(g)+3H2(g)=2NH3(g)  H =-92.4 kJ·mol-1。
H =-92.4 kJ·mol-1。
则氨的催化氧化反应的热化学方程式为 。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)  H<0。
H<0。
一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如图所示。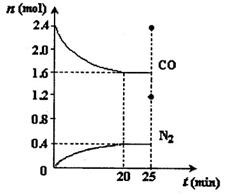
①NO的平衡转化率为 ,0~20min平均反应速率v(NO)为 。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将 移动(填“向左”、“向右”或“不”)。
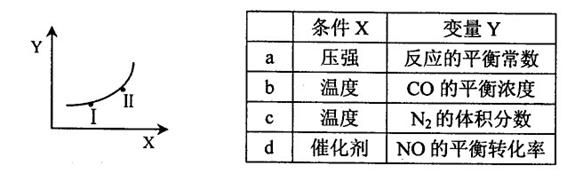
②若只改变某一反应条件X,反应由原平衡I达到新平衡II,变量Y的变化趋势如下图所示。下列说法正确的是 (填字母代号)。
|
 (3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。
(3)某化学小组拟设计以N2和H2为电极反应物,以HCl—NH4Cl为电解质溶液制成燃料电池,则该电池的正极反应式为 。假设电解质溶液的体积不变,下列说法正确的是 (填字母代号)。 1023个电子,则有标准状况下11.2L电极反应物被氧化
1023个电子,则有标准状况下11.2L电极反应物被氧化(1)4NH3(g)+5O2(g) 4NO(g) +6H2O(g) ΔH=﹣905kJ·mol-1(3分)
4NO(g) +6H2O(g) ΔH=﹣905kJ·mol-1(3分)
(2)① 28.6%(2分) 0.02 mol·L-1·min-1(2分) 向左(2分)
② b(3分)
(3) N2+8H++6e-=2NH4+(3分)Bcd(3分)
解析试题分析:(1)先写出NH3与O2反应的化学方程式,并注明物质的状态,然后根据盖斯定律求算?H,?H=2×?H1+3×?H2—2×?H3=﹣905kJ·mol-1,可得热化学方程式:4NH3(g)+5O2(g) 4NO(g) +6H2O(g) ΔH=﹣905kJ·mol-1。
4NO(g) +6H2O(g) ΔH=﹣905kJ·mol-1。
(2)①根据三段式进行计算,2NO(g)+2CO(g)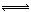 N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度(mol?L?1) 1.4 1.2 0 0
转化浓度(mol?L?1) 0.4 0.4 0.2 0.4
平衡浓度(mol?L?1) 1.0 0.8 0.2 0.4
则NO的转化率为:0.4mol/L÷1.4mol/L×100%=28.6%;0~20min平均反应速率v(NO)=0.4mol/L÷20min=" 0.02" mol·L-1·min-1;根据平衡浓度可求出平衡常数K=0.2×0.42÷(12×0.82)=0.05,加入CO、N2后Q=0.6×0.42÷(12×1.22)=0.22,因为Q>K,所以平衡向左移动。
②a、压强增大,化学平衡常数不变,不符合图像,错误;b、因为该反应为放热反应,温度升高,平衡向左移动,所以CO浓度增大,符合图像,正确;c、因为该反应为放热反应,温度升高,平衡向左移动,所以N2的体积分数减小,不符合图像,错误;d、催化剂不影响化学平衡,NO的平衡转化率不变,不符合图像,错误。
(3)N2的氧化性大于H2,所以正极上N2得电子,根据化合价的变化可得电解方程式:N2+8H++6e-=2NH4+;a、该燃料电池的总反应为:N2+3H2+2H+=2NH4+,消耗了H+,所以pH增大,错误;b、根据电池反应,生成了NH4+,所以溶液中的NH4Cl浓度增大,但Cl-离子浓度不变,正确;c、H2被氧化,电子转移为:H2 ~ 2e?,所以每转移6.02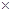 1023个电子,则有标准状况下11.2L电极反应物被氧化,正确;d、随着电池反应的进行,NH4+的浓度越大,所以为保持放电效果,电池使用一段时间需更换电解质溶液,正确。
1023个电子,则有标准状况下11.2L电极反应物被氧化,正确;d、随着电池反应的进行,NH4+的浓度越大,所以为保持放电效果,电池使用一段时间需更换电解质溶液,正确。
考点:本题考查热化学方程式的书写、转化率和平衡的计算、图像的分析、原电池的原理。


科目:高中化学 来源: 题型:填空题
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+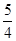 O2(g)===
O2(g)===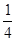 P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。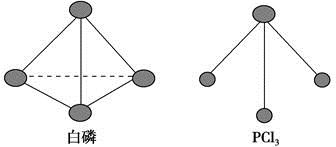
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。 
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应: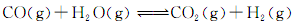 ,得到如下三组数据:
,得到如下三组数据: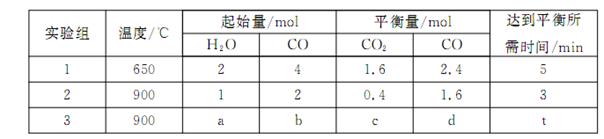
①实验1中,以v( H2)表示的平均反应速率为: 。
②该反应的正反应为 (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 (用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。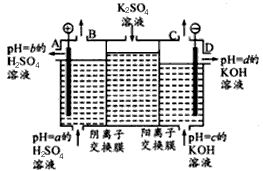
①该电解槽中通过阴离子交换膜的离子数 (填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B出口与C出口产生气体的质量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g) +3H2(g) =CH3OH(g)+H2O(g) △H1
2CO (g) +O2(g) =2CO2(g) △H2
2H2(g)+O2(g) =2H2O(g) △H3
则 CO(g) + 2H2(g)  CH3OH(g) 的△H= 。
CH3OH(g) 的△H= 。
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H 0 (填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H 0 (填>、<或=)。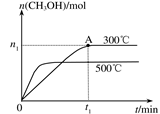
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是 。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:
1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
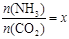 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是 。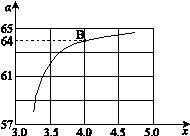

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(创新预测题)将煤转化为水煤气的主要化学反应为C(s)+H2O(g)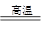 CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+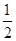 O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+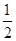 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图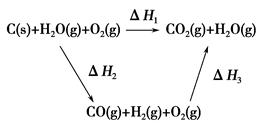
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是
_______________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图A所示,则该反应的ΔH 0(填“>”、“<”或“=”)。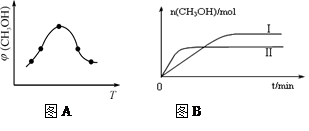
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图B所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>” 或“<”)。
(3)以CO2为原料还可以合成多种物质。①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比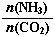 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知甲和乙在溶液中的转化关系如图所示: 。请回答下列问题:
。请回答下列问题:
(1)若甲是10电子的阳离子,乙是碱性气体。1 mol乙通入足量强酸溶液中与H+反应,反应过程中的能量变化如图。写出乙的一种用途________________。该反应的热化学方程式为___________________________。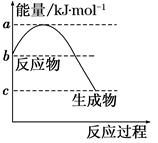
(2)若甲是CO2,用CO2和NH3反应可以合成尿素,合成尿素的反应分为如下两步。
第一步:2NH3(l)+CO2(g) H2NCOONH4(l)(氨基甲酸铵) ΔH1
H2NCOONH4(l)(氨基甲酸铵) ΔH1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2
在一体积为0.5 L的密闭容器中投入4 mol氨和1 mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如图Ⅰ所示。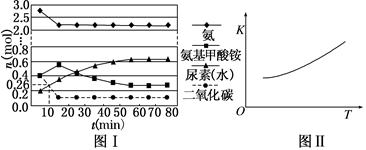
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定。
②反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则前10 min用CO2表示的第一步反应的速率为________。
③第二步反应的平衡常数K随温度的变化如图Ⅱ所示,则ΔH2________0(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com