
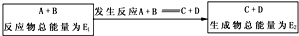
分析 (1)首先根据离子方程式电荷守恒判断n值,从化合物中化合价代数和为0的角度判断Y元素的化合价,进而判断最外层电子数,Y为Cl元素;电子层结构相同,核电荷数越大离子半径越小;
(2)反应物总能量小于生成物总能量反应为吸热反应;反应物总能量大于生成物总能量反应为放热反应.
解答 解:(1)(a)离子方程式遵循电荷守恒,则在YO3n-+3S2-+6H+=Y-+3S↓+3H2O中:n+3×2-6=1,n=1,设YO3n-中Y元素的化合价为x,则-2×3+x=-1,x=+5,由离子方程式可知,Y的最低负价为-1价,则说明最外层含有7个电子,故答案为:+5;7;
(b)Y的最低负价为-1价,则说明最外层含有7个电子,Y为Cl元素,Cl-、S2-电子层结构相同,核电荷数越大离子半径越小,故离子半径:Cl-<S2-,故答案为:大于;
(2)(a)若E1>E2,反应体系的总能量降低,则生成物的总能量小于反应物的总能量,依据反应前后能量守恒可知反应是放热反应,故答案为:降低;放热;
(b)若E1<E2,反应体系的总能量升高,则生成物的总能量大于反应物的总能量,依据反应前后能量守恒可知反应是吸热反应,故答案为:升高;吸热.
点评 本题考查元素化合价的判断和化学反应的能量变化,题目难度中等,注意本题易错点为Y元素原子的最外层电子数的判断,不能根据正化合价判断,当Y元素的不处于最高正价时,不能用来判断最外层电子数.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作 |
| A | 从溴水中提取单质溴 | 先用CCl4 萃取分液后,再蒸馏 |
| B | 证明 Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3 溶液 |
| C | 验证蔗糖是否水解生成葡萄糖 | 向蔗糖溶液中加入少量稀硫酸加热,再加入少量NaOH溶液,调至碱性,然后加银氨溶液水浴加热 |
| D | 证明碱的非金属性强于硅 | 向NaSiO3溶液中通入适量CO2 气体,有白色胶状沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其它条件不变,增大压强,平衡不发生移动 | |
| B. | 该反应式中n值一定为2 | |
| C. | 其它条件不变,增大压强,混合气体的总质量不变 | |
| D. | 原混合气中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳元素是构成有机物的基础元素.
碳元素是构成有机物的基础元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑤ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类不一定都是高分子化合物,但水解产物相同 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,证明甲苯分子中存在单双键交替的结构 | |
| C. | 利用粮食酿酒经过了由淀粉→葡萄糖→乙醇的化学变化过程 | |
| D. | 甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
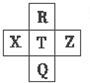 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 最高价氧化物对应的水化物的酸性:X<T<Q | |
| B. | 由于键能EH-R>EH-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
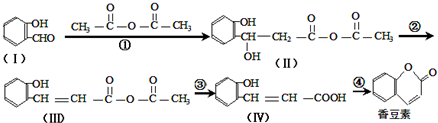
 .
. .
.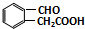 或
或 (任写一种).
(任写一种).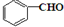 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、KOH、CaCO3、H2O都是强电解质 | |
| B. | Na2O2、CaO、Al2O3都是碱性化合物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. | 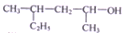 的名称为4-甲基-2-己醇 的名称为4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{218}$Pu的质子数为94,中子数为238,电子数为144 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com