
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 65 | 249 | 199.6 |
| 检验项目 | 实验现象及结论 |
| 检验粗产品中含有水的操作是 | |
| 检验粗产品中含有硫酸的操作是 |
分析 (1)溶液混合时,将密度大的液体倒入密度小的液体中;
(2)蒸馏时沸石或碎瓷片起防暴沸的作用;
(3)增大一种反应物的物质的量,能增大另一种物质的转化率;
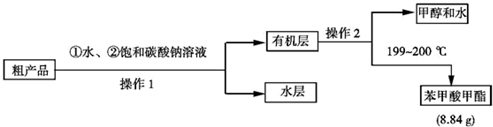
苯甲酸甲酯中含有苯甲酸和甲醇,苯甲酸和甲醇易溶于水,苯甲酸甲酯不易溶于水,饱和碳酸钠能吸收甲醇且能和苯甲酸分液生成可溶性的苯甲酸钠,苯甲酸甲酯不反应,然后分液得到水层和有机层,有机层中含有苯甲酸甲酯和甲醇,然后利用蒸馏方法得到苯甲酸甲酯、甲醇和水;
(4)分离互不相溶的液体采用分液方法,分离互溶的液体采用蒸馏方法;
(5)n(甲醇)=$\frac{0.79g/mL×20mL}{32g/mol}$=0.49mol,n(苯甲酸)=$\frac{12.2g}{122g/mol}$=0.1mol<0.49mol,则甲醇过量,根据苯甲酸与苯甲酸甲酯关系式知,理论上生成0.1mol苯甲酸甲酯,其质量=0.1mol×136g/mol=13.6g,其产率=$\frac{实际质量}{理论质量}$×100%;
(6)水能使无水硫酸铜由白色变为蓝色,所以可以用无水硫酸铜检验水蒸气;
硫酸能和氯化钡反应生成难溶性的硫酸钡沉淀,可以用氯化钡溶液检验硫酸.
解答 解:(1)溶液混合时,将密度大的液体倒入密度小的液体中,苯甲酸和甲醇密度都小于浓硫酸,所以混合溶液先后顺序是先加入12.2 g苯甲酸和20 mL甲醇,再小心加入3 mL浓硫酸,故答案为:先加入12.2 g苯甲酸和20 mL甲醇,再小心加入3 mL浓硫酸;
(2)蒸馏时沸石或碎瓷片起防暴沸的作用,为防止溶液暴沸,所以在加热前需要加入沸石或碎瓷片,
故答案为:加入几粒沸石或碎瓷片;
(3)增大一种反应物的物质的量,能增大另一种物质的转化率,所以甲醇的量较多时能提高苯甲酸的转化率,且甲醇沸点低易损伤,甲醇比苯甲酸廉价,
故答案为:该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,故可增加甲醇的量,以提高苯甲酸的转化率;
苯甲酸甲酯中含有苯甲酸和甲醇,苯甲酸和甲醇易溶于水,苯甲酸甲酯不易溶于水,饱和碳酸钠能吸收甲醇且能和苯甲酸分液生成可溶性的苯甲酸钠,苯甲酸甲酯不反应,然后分液得到水层和有机层,有机层中含有苯甲酸甲酯和甲醇,然后利用蒸馏方法得到苯甲酸甲酯、甲醇和水;
(4)分离互不相溶的液体采用分液方法,分离互溶的液体采用蒸馏方法,所以操作①是分液、操作②是蒸馏,
故答案为:分液;蒸馏;
(5)n(甲醇)=$\frac{0.79g/mL×20mL}{32g/mol}$=0.49mol,n(苯甲酸)=$\frac{12.2g}{122g/mol}$=0.1mol<0.49mol,则甲醇过量,根据苯甲酸与苯甲酸甲酯关系式知,理论上生成0.1mol苯甲酸甲酯,其质量=0.1mol×136g/mol=13.6g,其产率=$\frac{实际质量}{理论质量}$×100%=$\frac{8.84g}{13.6g}$×100%=65%,
故答案为:65%;
(6)水能使无水硫酸铜由白色变为蓝色,所以可以用无水硫酸铜检验水蒸气,其检验方法是:取适量产品置于试管中,加入适量无水硫酸铜,如果固体变蓝色,则说明产品中含有水,否则不含水;
硫酸能和氯化钡反应生成难溶性的硫酸钡沉淀,可以用氯化钡溶液检验硫酸,其检验方法是:取适量产品置于试管中,加入适量氯化钡溶液,如果有白色沉淀生成,则说明产品中含有硫酸,否则不含硫酸,
故答案为:
| 检验项目 | 实验现象及结论 |
| 检验粗产品中含有水的操作是:取适量产品置于试管中,加入适量无水硫酸铜 | ,如果固体变蓝色,则说明产品中含有水,否则不含水 |
| 检验粗产品中含有硫酸的操作是:取适量产品置于试管中,加入适量氯化钡溶液 | 如果有白色沉淀生成,则说明产品中含有硫酸,否则不含硫酸 |
点评 本题考查物质制备,为高频考点,涉及实验基本操作、方程式计算、物质检验、物质分离和提纯,明确实验原理、实验基本操作方法、物质性质等知识点是解本题关键,注意(1)中溶液滴加先后顺序,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
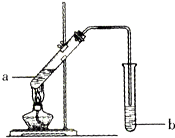 如图为实验室制备乙酸乙醋的装置.
如图为实验室制备乙酸乙醋的装置.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 乙醇 | -114 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 浓H2SO4 | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
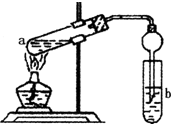 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
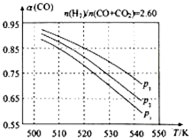 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=1.2 mol/(L•s) | B. | v(NO2)=0.3 mol/(L•min) | ||
| C. | v(N2)=0.6 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应发生时不必加热 | |
| B. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应在常温下一定很容易发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com