
| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH=7 |
| 丙 | c(HZ)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH=b |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源:2012-2013学年吉林省长春市十一高中高二上学期期末考试化学试卷(带解析) 题型:填空题
(8分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)="0.1" mol/L | c(NaOH)=0.1mol/L | pH = a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH = 7 |
| 丙 | c(HZ)="0.1" mol/L | c(NaOH)=0.1mol/L | pH = 9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH = b |
查看答案和解析>>
科目:高中化学 来源:2014届吉林省长春市高二上学期期末考试化学试卷(解析版) 题型:填空题
(8分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
|
组别 |
一元酸 |
NaOH |
混合溶液的pH |
|
甲 |
c(HX)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = a |
|
乙 |
c(HY)=c1 mol/L |
c(NaOH)=0.1mol/L |
pH = 7 |
|
丙 |
c(HZ)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = 9 |
|
丁 |
pH=2 HZ |
pH=12 NaOH |
pH = b |
(1)甲组实验中HX为弱酸,a 7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为 。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年西藏拉萨中学高三第五次月考理综化学部分 题型:填空题
(每空3分,共12分)常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
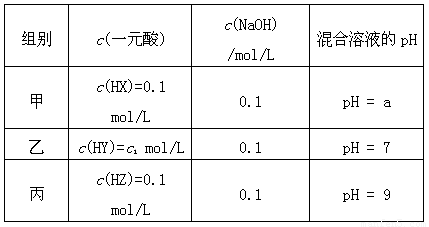
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”)。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c(OH-) = mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | 一元酸 | NaOH | 混合溶液的pH |
| 甲 | c(HX)=0.1 mol/L | c(NaOH)=0.1mol/L | pH = a |
| 乙 | c(HY)=c1 mol/L | c(NaOH)=0.1mol/L | pH = 7 |
| 丙 | c(HZ)=0.1 mol/L | c(NaOH)=0.1mol/L | pH = 9 |
| 丁 | pH=2 HZ | pH=12 NaOH | pH = b |
(1)甲组实验中HX为弱酸,a______7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为 。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com