
| A.MnS的Ksp比CuS的Ksp大 | ||
| B.该反应达到平衡时c(Mn2+)=c(Cu2+) | ||
| C.往平衡体系中加入少量CuSO4固体后,C(Mn2+)变大 | ||
D.该反应的平衡常数K=
|
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶解度.Ksp均不变 | B.溶解度.Ksp均变大 |
| C.结晶过程停止,溶解过程加快 | D.结晶过程将小于溶解过程,直至再达到平衡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向溶液中加少量CaO,达新平衡后,溶液的pH不变 |
| B.向溶液中加少量CaO,达新平衡后,溶液的pH降低 |
| C.向溶液中加入Na2CO3溶液,其中Ca(OH)2固体质量增加 |
| D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.负极,并被氧化 | B.正极,并被还原 |
| C.负极,并被还原 | D.正极,并被氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
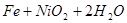
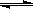
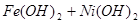 ,下列有关爱迪生电池的各种推断中错误的是( )。
,下列有关爱迪生电池的各种推断中错误的是( )。A.放电时铁做负极,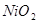 做正极 做正极 |
B.充电时阴极上的电极反应为: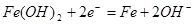 |
| C.放电时,电解质溶液中的阴离子是向正极方向移动 |
| D.蓄电池的两个电极必须浸入在碱性溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com