
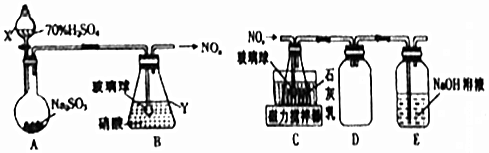
分析 A装置由浓硫酸和亚硫酸钠制备二氧化硫气体,二氧化硫气体与硝酸在B中反应生成氮氧化合物,在C中与石灰乳发生反应NO+NO2+Ca(OH)2=Ca(NO2)2+H2O,可制备得Ca(NO2)2,D装置防倒吸,E装置用氢氧化钠吸收未反应完的氮氧化物,防止污染空气,据此分析解答.
解答 解:(1)①由仪器构造可知X为分液漏斗,Y为锥形瓶;
故答案为:分液漏斗;锥形瓶;
②装置B中逸出的NO与NO2的物质的量之比为1:1,则装置B中发生反应的化学方程式为2SO2+H2O+2HNO3=NO+NO2+2H2SO4;故答案为:2SO2+H2O+2HNO3=NO+NO2+2H2SO4;
(2)①装置C中导管末端接一玻璃球可增大与石灰乳的接触面积;
故答案为:增大与石灰乳的接触面积;
②装置D的作用是防倒吸,E装置用氢氧化钠吸收未反应完的氮氧化物,防止污染空气;
故答案为额:防倒吸;吸收未反应的氮氧化物;
(3)①由信息Ca(NO2)2能被酸性KmnO4溶液氧化成NO3-,MnO4-被还原为Mn2+可知,则利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是e;
故答案为:e;
②由信息在酸性条件下,Ca(NO3)2能将I-氧化为I2,S2O32-能将I2还原为I-可知,则利用Ca(NO2)2的氧化性来测定其纯度的步骤是:准确称取质量为m的Ca(NO2)2样品放入锥形瓶中,加适量水溶解,加入过量的c1 mol•L-1 KI溶液、淀粉溶液,然后滴加稀硫酸,用c2 mol•L-1 Na2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读取消耗的Na2S2O3溶液体积,重复以上操作2~3次;
故答案为:加入过量的c1 mol•L-1 KI溶液、淀粉溶液,然后滴加稀硫酸,用c2 mol•L-1 Na2S2O3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读取消耗的Na2S2O3溶液体积,重复以上操作2~3次.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、实验装置的作用、氧化还原反应的应用为解答的关键,侧重分析与实验及应用能力的综合考查,题目难度中等.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
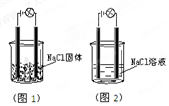 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | B. | NaCl溶液是电解质 | ||
| C. | NaCl在水溶液中离子键发生断裂 | D. | NaCl溶液中水电离出大量的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质一定是纯净物 | |
| B. | 科学家最近合成了一种新型的化合物N4 | |
| C. | 红磷转化为白磷是物理变化 | |
| D. | 纳米泡沫碳与金刚石是同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H4=$\frac{3}{2}$(△H1+△H2+3△H3) | B. | △H4=$\frac{2}{3}$(3△H3-△H1-△H2) | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2-3△H3) | D. | △H4=$\frac{3}{2}$(△H1-△H2-3△H3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com