
【题目】下列反应中不是氧化还原反应的是( )
A.2KMnO4 +16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
B.2NaHCO3 ![]() Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
C.Cl2 + SO2 + 2H2O = H2SO4 + 2HCl
D.2Na + 2H2O = 2NaOH + H2↑
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。

回答下列问题:
(1)甲的分子式为__________。
(2)丙中含有官能团的名称是__________。
(3)反应①的反应类型是________;反应②的反应类型是_______。
(4)反应④的化学方程式_______。
(5)符合下列条件的乙的同分异构体共有______种。
①能发生银镜反应
②能与NaHCO3溶液反应,且1mol乙与足量NaHCO3溶液反应时产生气体22.4L(标准状况)。
写出其中在核磁共振氢谱中峰面积之比为1∶6∶2∶1的一种同分异构体的结构简式:________。(任意一种)
(6)设计以![]() (丙酮)、乙醇为原料制备
(丙酮)、乙醇为原料制备![]() (2,4—戊二醇)的合成路线(无机试剂任选)_______。
(2,4—戊二醇)的合成路线(无机试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,能说明反应A(s)+ 2B(g)![]() C(g)+ D(g)一定处于化学平衡状态的是
C(g)+ D(g)一定处于化学平衡状态的是
A. 混合气体的密度不再改变 B. 容器内的压强保持不变
C. C与D的物质的量相等 D. 消耗1 mol B的同时生成 0.5 mol D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中逐滴滴加2mol/L NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如下图所示。则:
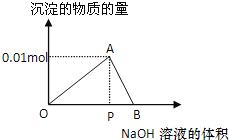
(1)写出代表各线段发生反应的离子方程式:OA段____________,AB段___________,图中线段OP∶PB=___________。
(2)计算原AlCl3溶液的物质的量浓度为_________。
(3)图中A对应的横坐标为______mL。
(4)当加入12mL NaOH溶液时,产生沉淀量为______mol。
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与CO2反应生成甲醇。已知:H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为285.8kJ·mol1、283.0kJ·mol1和726.5kJ·mol1。
请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是______kJ。
(2)写出表示H2(g)、CO(g)和CH3OH(l)燃烧热的热化学方程式。
①H2:__________;
②CO:__________;
③CH3OH:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu及化合物在生产、国防中有重要的应用。
I.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:Cu2O(s)+![]() O2(g)=2CuO(s) ΔH=-196kJ/mol
O2(g)=2CuO(s) ΔH=-196kJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-220.8kJ/mol
则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为___。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
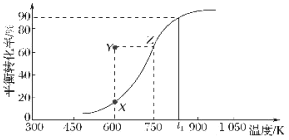
①该反应的ΔH___0(填“>”或“<”);600K时,Y点甲醇的v(正)___v(逆)(填“>”或“<”)。
②在t1K时,向固定体积为1L的密闭容器中充入2molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)___,温度为t1时,该反应的平衡常数K的值为___。
II.Cu既是常见的催化剂,又是常见的电极材料。
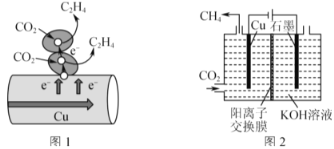
(3)图1表示的是利用CO2的“直接电子传递机理”。在催化剂铜的表面进行转化。当直接传递的电子物质的量为2mol时,则参加反应的CO2的物质的量为___。
(4)图2表示以KOH溶液作电解质溶液进行电解的示意图,CO2在Cu电极上可以转化为CH4,该电极反应的方程式为___。
III.含铜离子的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
(5)已知:Ksp(CuS)=1×10-36,要使铜离子的浓度符合排放标准(不超过0.4mg/L),溶液中的硫离子的物质的量浓度至少为___mol/L(保留至小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
I.实验室制取CuSO4溶液
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。
(1)请写出方案i反应的化学方程式____,其缺点是____(写1点)。
(2)实际生产中方案ii常常有紫红色固体未反应,猜想原因可能是____。
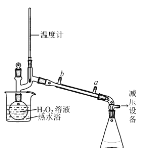
(3)基于此,实验进行了改进,其中一种方案是在硫酸和铜的反应容器中滴加H2O2溶液,观察到的现象是____(写1点)。H2O2的沸点为150.2℃。为加快反应需要提高H2O2溶液的浓度,可通过下图将H2O2稀溶液浓缩,冷水入口是____(填a或b),增加减压设备的目的是____。
II.一水硫酸四氨合铜晶体的制备
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式__________。
(5)继续滴加NH3·H2O,会转化成深蓝色溶液。从深蓝色溶液中析出深蓝色晶体的简便实验是滴加____________。
III.产品纯度的测定
(6)精确称取mg晶体,加适量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸气将氨全部蒸出,用V1mL0.200mol·L-1的盐酸完全吸收。以甲基橙作指示剂,用0.200mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。产品纯度的表达式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com