
”¾ĢāÄæ”æ¶ĢÖÜĘŚÖ÷×åŌŖĖŲX”¢Y”¢R”¢MµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ĘäÖŠÖ»ÓŠRŹōÓŚ½šŹōŌŖĖŲ£¬ÓÉX”¢Y”¢RæÉ×é³ÉŅ»ÖÖ»ÆŗĻĪļQ£¬ŌŚ298KŹ±£¬0.1mol”¤L”Ŗ1 QČÜŅŗµÄAG(Ėį¶Č)£½lg![]() £½£12£¬ÓÉXŗĶM×é³ÉµÄ»ÆŗĻĪļXMŹĒĒæµē½āÖŹ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
£½£12£¬ÓÉXŗĶM×é³ÉµÄ»ÆŗĻĪļXMŹĒĒæµē½āÖŹ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. Y”¢R”¢MČżÖÖŌŖĖŲŠĪ³ÉµÄ¼ņµ„Ąė×Ó°ė¾¶£ŗr(M)>r(R)>r(Y)
B. MµÄŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļŅ»¶ØŹĒĒæĖį
C. R·Ö±šÓėX”¢Y”¢M×é³ÉµÄ¶žŌŖ»ÆŗĻĪļÖŠ¶¼ŗ¬ÓŠĄė×Ó¼ü
D. »ÆŗĻĪļRYXŗĶRMY¾łÄÜŅÖÖĘĖ®µÄµēĄė
”¾“š°ø”æC
”¾½āĪö”æ¶ĢÖÜĘŚÖ÷×åŌŖĖŲX”¢Y”¢R”¢MµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬ĘäÖŠÖ»ÓŠRŹōÓŚ½šŹōŌŖĖŲ£¬ÓŠX”¢Y”¢RæÉ×é³ÉŅ»ÖÖ»ÆŗĻĪļQ£¬298KŹ±£¬0.1molL-1QČÜŅŗŹĒAG(Ėį¶Č)=lg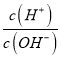 =-12£¬Ōņc(H+)=c(OH-)”Į10-12£¬½įŗĻĖ®µÄĄė×Ó»żæÉÖŖc(OH-)c(OH-)”Į10-12=10-14£¬Ōņc(OH-)=0.1mol/L£¬ĖµĆ÷QČÜŅŗĪŖŅ»ŌŖĒæ¼ī£¬ŌņQĪŖNaOH£¬øł¾ŻŌ×ÓŠņŹż“óŠ”æÉÖŖXĪŖH”¢YĪŖO”¢RĪŖNaŌŖĖŲ£»ÓÉXŗĶM×é³ÉµÄ»ÆŗĻĪļXMŹĒĒæµē½āÖŹ£¬MµÄŌ×ÓŠņŹż“óÓŚNa£¬ŌņMĪŖClŌŖĖŲ”£A£®RĪŖNa”¢YĪŖO”¢MĪŖClŌŖĖŲ£¬Ąė×ӵĵē×Ó²ćŌ½¶ą£¬Ąė×Ó°ė¾¶Ō½“󣬵ē×Ó²ćĻąĶ¬Ź±£¬Ąė×ÓµÄŗĖµēŗÉŹżŌ½“ó£¬Ąė×Ó°ė¾¶Ō½Š”£¬Ōņ¼ņµ„Ąė×Ó°ė¾¶£ŗM£¾Y£¾R£¬¹ŹA“ķĪó£»B£®MĪŖClŌŖĖŲ£¬Ęä×īøß¼ŪŃõ»Æ¶ŌÓ¦Ė®ŗĻĪļĪŖĒæĖį£¬Ć»ÓŠÖø³ö×īøß¼Ū£¬Ōņ¶ŌÓ¦Ėį²»Ņ»¶ØĪŖĒæĖį£¬Čē“ĪĀČĖį£¬¹ŹB“ķĪó£»C£®R(Na)ĪŖ»īĘĆ½šŹō£¬·Ö±šÓėX(H)”¢Y(O)”¢M(Cl)×é³ÉµÄ¶žŌŖ»ÆŗĻĪļÖŠ¶¼ŗ¬ÓŠĄė×Ó¼ü£¬¹ŹCÕżČ·£»D£®»ÆŗĻĪļRYXĪŖNaOH£¬RMYĪŖNaClO£¬ĒāŃõ»ÆÄĘŅÖÖĘĮĖĖ®µÄµēĄė£¬¶ų“ĪĀČĖįÄĘÄܹ»“Ł½ųĖ®µÄµēĄė£¬¹ŹD“ķĪó£»¹ŹŃ”C”£
=-12£¬Ōņc(H+)=c(OH-)”Į10-12£¬½įŗĻĖ®µÄĄė×Ó»żæÉÖŖc(OH-)c(OH-)”Į10-12=10-14£¬Ōņc(OH-)=0.1mol/L£¬ĖµĆ÷QČÜŅŗĪŖŅ»ŌŖĒæ¼ī£¬ŌņQĪŖNaOH£¬øł¾ŻŌ×ÓŠņŹż“óŠ”æÉÖŖXĪŖH”¢YĪŖO”¢RĪŖNaŌŖĖŲ£»ÓÉXŗĶM×é³ÉµÄ»ÆŗĻĪļXMŹĒĒæµē½āÖŹ£¬MµÄŌ×ÓŠņŹż“óÓŚNa£¬ŌņMĪŖClŌŖĖŲ”£A£®RĪŖNa”¢YĪŖO”¢MĪŖClŌŖĖŲ£¬Ąė×ӵĵē×Ó²ćŌ½¶ą£¬Ąė×Ó°ė¾¶Ō½“󣬵ē×Ó²ćĻąĶ¬Ź±£¬Ąė×ÓµÄŗĖµēŗÉŹżŌ½“ó£¬Ąė×Ó°ė¾¶Ō½Š”£¬Ōņ¼ņµ„Ąė×Ó°ė¾¶£ŗM£¾Y£¾R£¬¹ŹA“ķĪó£»B£®MĪŖClŌŖĖŲ£¬Ęä×īøß¼ŪŃõ»Æ¶ŌÓ¦Ė®ŗĻĪļĪŖĒæĖį£¬Ć»ÓŠÖø³ö×īøß¼Ū£¬Ōņ¶ŌÓ¦Ėį²»Ņ»¶ØĪŖĒæĖį£¬Čē“ĪĀČĖį£¬¹ŹB“ķĪó£»C£®R(Na)ĪŖ»īĘĆ½šŹō£¬·Ö±šÓėX(H)”¢Y(O)”¢M(Cl)×é³ÉµÄ¶žŌŖ»ÆŗĻĪļÖŠ¶¼ŗ¬ÓŠĄė×Ó¼ü£¬¹ŹCÕżČ·£»D£®»ÆŗĻĪļRYXĪŖNaOH£¬RMYĪŖNaClO£¬ĒāŃõ»ÆÄĘŅÖÖĘĮĖĖ®µÄµēĄė£¬¶ų“ĪĀČĖįÄĘÄܹ»“Ł½ųĖ®µÄµēĄė£¬¹ŹD“ķĪó£»¹ŹŃ”C”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪŽÉ«ĶøĆ÷µÄĖįŠŌČÜŅŗÖŠ£¬ÄÜ“óĮæ¹²“ęµÄĄė×Ó×éĪŖ
A.Na+ӢK+ӢSO42-ӢHS-B.Na+ӢK+ӢSiO32-ӢNO3-
C.Na+ӢK+ӢCl-ӢSO42-D.Fe3+ӢNO3-ӢSO42-ӢCl-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀŹ±£¬Ļņ20mL 0.1 mol/LµÄCH3COOHČÜŅŗÖŠÖšµĪµĪ¼Ó0.1 mol/LµÄNaOHČÜŅŗ£¬µĪČėNaOHČÜŅŗµÄĢå»żÓėČÜŅŗpHµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
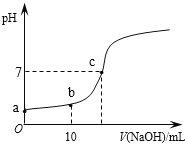
A. aµćµÄpH=1
B. bµćŹ±£¬c (CH3COO”Ŗ)=0.05mol/L
C. cµćŹ±£¬V(NaOH)=20mL
D. ·“Ó¦¹ż³ĢÖŠ![]() µÄÖµ²»¶ĻŌö“ó
µÄÖµ²»¶ĻŌö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĢį“æĻĀĮŠĪļÖŹ£ØĄØŗÅÄŚĪŖŌÓÖŹ£©£¬Ź¹ÓƵďŌ¼ĮŗĶ·ÖĄė·½·Ø¶¼ÕżČ·µÄŹĒ£Ø £©
ĪļÖŹ | ŹŌ¼Į | ·ÖĄė·½·Ø | |
¢Ł | ĻõĖį¼Ų£ØĀČ»ÆÄĘ£© | ÕōĮóĖ® | ½µĪĀ½į¾§ |
¢Ś | ¶žŃõ»ÆĢ¼£ØĀČ»ÆĒā£© | ±„ŗĶĢ¼ĖįÄĘČÜŅŗ | Ļ“Ęų |
¢Ū | ŅŅ“¼£ØĖ®£© | ÉśŹÆ»Ņ | ÕōĮó |
¢Ü | ĀČ»Æļ§£ØĀČ»ÆĢś£© | ĒāŃõ»ÆÄĘČÜŅŗ | ¹żĀĖ |
A.¢Ł¢ŚB.¢Ł¢ŪC.Ö»ÓŠ¢ŪD.¢Ū¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ”×éŃŠ¾æNa2SČÜŅŗÓėKMnO4ČÜŅŗ·“Ó¦£¬Ģ½¾æ¹ż³ĢČēĻĀ”£
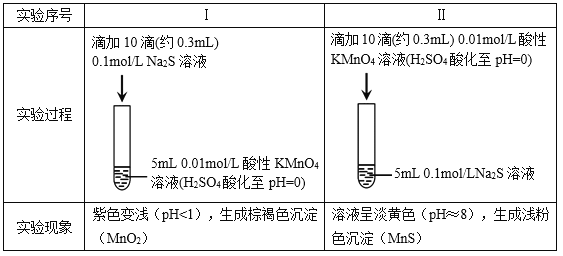
׏ĮĻ£ŗ¢”. ![]() ŌŚĒæĖįŠŌĢõ¼žĻĀ±»»¹ŌĪŖMn2+£¬ŌŚ½üÖŠŠŌĢõ¼žĻĀ±»»¹ŌĪŖMnO2”£
ŌŚĒæĖįŠŌĢõ¼žĻĀ±»»¹ŌĪŖMn2+£¬ŌŚ½üÖŠŠŌĢõ¼žĻĀ±»»¹ŌĪŖMnO2”£
¢¢. µ„ÖŹĮņæÉČÜÓŚĮņ»ÆÄĘČÜŅŗ£¬ČÜŅŗ³Źµ»ĘÉ«”£
£Ø1£©øł¾ŻŹµŃéæÉÖŖ£¬Na2S¾ßÓŠ________ŠŌ”£
£Ø2£©¼×Ķ¬Ń§Ō¤²āŹµŃéIÖŠS2ØC±»Ńõ»Æ³É![]() ”£
ӣ
¢Łøł¾ŻŹµŃéĻÖĻó£¬ŅŅĶ¬Ń§ČĻĪŖ¼×µÄŌ¤²ā²»ŗĻĄķ£¬ĄķÓÉŹĒ________”£
¢ŚŅŅĶ¬Ń§Č”ŹµŃéIÖŠÉŁĮæČÜŅŗ½ųŠŠŹµŃ飬¼ģ²āµ½ÓŠ![]() £¬µĆ³öS2ØC±»Ńõ»Æ³É
£¬µĆ³öS2ØC±»Ńõ»Æ³É![]() µÄ½įĀŪ£¬±ūĶ¬Ń§·ń¶ØĮĖøĆ½įĀŪ£¬ĄķÓÉŹĒ________”£
µÄ½įĀŪ£¬±ūĶ¬Ń§·ń¶ØĮĖøĆ½įĀŪ£¬ĄķÓÉŹĒ________”£
¢ŪĶ¬Ń§ĆĒ¾ĢÖĀŪŗó£¬Éč¼ĘĮĖČēĻĀŹµŃ飬֤ŹµøĆĢõ¼žĻĀ![]() µÄČ·æÉŅŌ½«S2ØCŃõ»Æ³É
µÄČ·æÉŅŌ½«S2ØCŃõ»Æ³É![]() ”£
ӣ
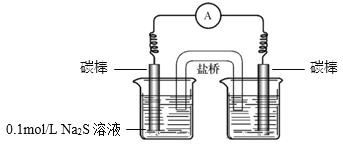
a.ÓŅ²ąÉÕ±ÖŠµÄČÜŅŗŹĒ________”£
b.Į¬ĶØŗóµēĮ÷¼ĘÖøÕėĘ«×Ŗ£¬Ņ»¶ĪŹ±¼äŗó£¬________£ØĢī²Ł×÷ŗĶĻÖĻ󣩔£
£Ø3£©ŹµŃéIµÄĻÖĻóÓė׏ĮĻi“ęŌŚ²īŅģ£¬ĘäŌŅņŹĒŠĀÉś³ÉµÄ²śĪļ£ØMn2+£©Óė¹żĮæµÄ·“Ó¦Īļ£Ø![]() £©·¢Éś·“Ó¦£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ________”£
£©·¢Éś·“Ó¦£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ________”£
£Ø4£©ŹµŃéIIµÄĻÖĻóÓė׏ĮĻŅ²²»ĶźČ«Ļą·ū£¬¶”Ķ¬Ń§²ĀĻėĘäŌŅņÓė£Ø3£©ĻąĖĘ£¬¾ŃéÖ¤²ĀĻė³ÉĮ¢£¬ĖūµÄŹµŃé·½°øŹĒ______”£
£Ø5£©·“Ė¼øĆŹµŃ飬·“Ó¦ĪļĻąĶ¬£¬¶ųĻÖĻó²»Ķ¬£¬ĢåĻÖĮĖĪļÖŹ±ä»Æ²»½öÓėĘä×ŌÉķµÄŠŌÖŹÓŠ¹Ų£¬»¹Óė________ŅņĖŲÓŠ¹Ų”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潚ŹōĒāŃõ»ÆĪļŌŚĖįÖŠČܽā¶Č²»Ķ¬£¬Ņņ“ĖæÉŅŌĄūÓĆÕāŅ»ŠŌÖŹ£¬æŲÖĘČÜŅŗµÄpH£¬“ļµ½·ÖĄė½šŹōĄė×ÓµÄÄæµÄ”£ÄŃČܽšŹōµÄĒāŃõ»ÆĪļŌŚ²»Ķ¬pHĻĀµÄČܽā¶Č(S/mol/L)ČēĶ¼ĖłŹ¾”£

£Ø1£©µ±pH£½3Ź±£¬ČÜŅŗÖŠĶŌŖĖŲµÄÖ÷ŅŖ“ęŌŚŠĪŹ½ŹĒ__________”£
£Ø2£©ČōŅŖ³żČ„CuCl2ČÜŅŗÖŠµÄÉŁĮæFe3£«£¬Ó¦øĆæŲÖĘČÜŅŗµÄpHÖµĪŖ______ (ĢīŠņŗÅ)”£
A£®£¼1””””B£®4×óÓŅ”” C£®8£¾PH£¾6 D£®£¾9
£Ø3£©ŌŚNi(NO3)2ČÜŅŗÖŠŗ¬ÓŠÉŁĮæµÄCo2£«ŌÓÖŹ£¬________(Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±)Ķعżµ÷½ŚČÜŅŗpHµÄ·½·ØĄ“³żČ„£¬ĄķÓÉŹĒ_____________________________________________”£
£Ø4£©ŅŃÖŖŅ»Š©ÄŃČܵē½āÖŹµÄČܶȻż³£ŹżČēÓŅĻĀ±ķ£ŗ
ĪļÖŹ | FeS | MnS | PbS | HgS | ZnS | CuS |
Ksp | 6.3”Į10£18 | 2.5”Į10£13 | 3.4”Į10£28 | 6.4”Į10£33 | 1.6”Į10£24 | 1.3”Į10£35 |
ĪŖ³żČ„ij¹¤Ņµ·ĻĖ®ÖŠŗ¬ÓŠµÄCu2£«”¢Pb2£«”¢Hg2£«ŌÓÖŹ£¬×īŹŹŅĖĻņ“Ė¹¤Ņµ·ĻĖ®ÖŠ¼ÓČė¹żĮæµÄ___________(ĢīŠņŗÅ)”£
A£®NaOH”” ””B£®FeS”””” ””C£®Na2S D£®NH4Cl
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌÓŚ»ģŗĻĪļµÄ·ÖĄė»ņĢį“棬³£²ÉÓƵķ½·ØÓŠ£ŗ¹żĀĖ”¢Õō·¢”¢ÕōĮó”¢ŻĶČ””¢ÉųĪö”¢¼ÓČČ·Ö½āµČ£®ĻĀĮŠø÷×é»ģŗĻĪļµÄ·ÖĄė»ņĢį“æÓ¦²ÉÓĆŹ²Ć“·½·Ø£æ
£Ø1£©ŹµŃéŹŅÖŠµÄŹÆ»ŅĖ®¾ĆÖĆ£¬ŅŗĆęÉĻ³£Šüø”ÓŠCaCO3Ī¢Į££®æÉÓƵķ½·Ø³żČ„Ca£ØOH£©2ČÜŅŗÖŠŠüø”µÄCaCO3æÅĮ££®
£Ø2£©ŹµŃéŹŅÖŠÖĘČ”µÄFe£ØOH£©3½ŗĢåÖŠ³£³£ŗ¬ÓŠŌÓÖŹCl© £® æÉÓƵķ½·Ø³żČ„Fe£ØOH£©3½ŗĢåÖŠ»ģÓŠµÄŌÓÖŹCl© £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØµÄĪĀ¶ČŗĶŃ¹ĒæĻĀ£¬aĢå»żµÄX2ĘųĢåŗĶ3aĢå»żµÄY2ĘųĢå»ÆŗĻÉś³É2aĢå»żµÄĘųĢå»ÆŗĻĪļ£¬ŌņøĆ»ÆŗĻĪļµÄ»ÆѧŹ½ŹĒ£Ø £©
A.XY3B.XYC.X3YD.X2Y3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀÓŠÅØ¶Č¾łĪŖ0.1 mol![]() µÄĖÄÖÖČÜŅŗ£ŗ¢ŁNa2CO3 ¢ŚNaHCO3 ¢ŪHCl ¢ÜNH3”¤H2O
µÄĖÄÖÖČÜŅŗ£ŗ¢ŁNa2CO3 ¢ŚNaHCO3 ¢ŪHCl ¢ÜNH3”¤H2O
£Ø1£©ÓŠČĖ³ĘČÜŅŗ¢ŁŹĒÓĶĪŪµÄ”°ĒåµĄ·ņ”±£¬ŌŅņŹĒ_____________________£ØÓĆĄė×Ó·½³ĢŹ½½āŹĶ£©
£Ø2£©ÕāĖÄÖÖČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶ČÓɓ󵽊”µÄĖ³ŠņŹĒ£ØÓĆŠņŗÅĢīŠ“£©______________________
£Ø3£©Ļņ¢ÜÖŠ¼ÓČėÉŁĮæĀČ»Æļ§¹ĢĢ壬“ĖŹ±![]() µÄÖµ___________£ØĢī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©”£
µÄÖµ___________£ØĢī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø4£©µČĢå»ż»ģŗĻ¢ŪŗĶ¢ÜµÄČÜŅŗ£¬“ĖŹ±ČÜŅŗÖŠ[NH4+]+[NH3”¤H2O]£½_____________mol”¤L£1£ØĢīŹżÖµ£©£»“ĖŹ±ČÜŅŗÖŠĄė×ÓÅØ¶ČµÄ“óŠ”Ė³ŠņŹĒ£ŗ__________________________£»Čō½«¢ŪŗĶ¢ÜµÄČÜŅŗ»ģŗĻŗóČÜŅŗĒ”ŗĆ³ŹÖŠŠŌ£¬Ōņ»ģŗĻĒ°¢ŪµÄĢå»ż_________¢ÜµÄĢå»ż£ØĢī”°“óÓŚ”±Š”ÓŚ”±»ņ”°µČÓŚ”±£©
£Ø5£©½«10 mLČÜŅŗ¢Ū¼ÓĖ®Ļ”ŹĶÖĮ100 mL£¬Ōņ“ĖŹ±ČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc( H£«)=___________ mol”¤L£1”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com