
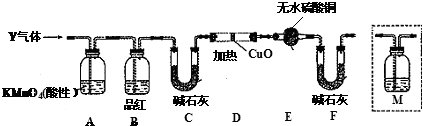
分析 (1)依据浓硫酸的强氧化性解答,常温下铁遇到浓硫酸发生钝化;
(2)①二价铁离子具有强的还原性,能够使酸性的高锰酸钾褪色,检验Fe2+,可利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
②生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数;
(3)二氧化硫能使品红溶液褪色,从而检验二氧化硫是否除尽;
(4)加热条件下,C和浓硫酸反应生成二氧化碳、二氧化硫和水;
(5)在确定不存在二氧化硫条件下,将气体通入澄清石灰水检验是否含有二氧化碳;
(6)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色.
解答 解:(1)浓硫酸具有强的氧化性,常温下遇到铁发生钝化,形成致密氧化膜阻止反应进行;
故答案为:常温下浓硫酸使铁钝化;
(2)①a.溶液中含有三价铁离子,遇到硫氰酸钾显红色,对二价铁离子检验造成干扰,故a不选;
b.溶液中含有三价铁离子,和NaOH反应生成红褐色沉淀,亚铁离子和NaOH反应生成白色沉淀,但不稳定,立即转化为黄绿色最终转化为红褐色沉淀,所以无论是否含有亚铁离子,加入浓氨水都产生红褐色沉淀,故b不选;
c.亚铁离子和浓氨水反应生成白色沉淀,但不稳定,立即转化为黄绿色最终转化为红褐色沉淀,铁离子和浓氨水反应生成红褐色沉淀,所以无论是否含有亚铁离子,加入浓氨水都产生红褐色沉淀,故c不选;
d.二价铁离子具有强的还原性,能够使酸性的高锰酸钾褪色,三价铁离子不具有还原性,不能使高锰酸钾褪色,所以可以用来检验二价铁离子,故d选;
故答案为:d;
②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,
n(混合气体)=$\frac{0.336L}{22.4L/mol}$=0.015mol,
SO2 →BaSO4
1mol 233g
n 2.33g
n=0.01mol;
则 SO2的体积分数:$\frac{0.01mol}{0.015mol}$×100%=66.7%,
故答案为:66.7%;
(3)A除去二氧化硫,二氧化硫能使品红溶液褪色,所以B可以检验A中是否完全除去二氧化硫,
故答案为:检验SO2是否除尽;
(4)加热条件下,C和浓硫酸反应生成二氧化碳,所以Q是二氧化碳,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(5)实验室用澄清石灰水检验二氧化碳,但二氧化硫也能使澄清石灰水变浑浊,要检验二氧化碳应该排除二氧化硫的干扰,所以在确定不存在二氧化硫条件下,将气体通入澄清石灰水检验是否含有二氧化碳,该检验装置应该在B-C之间,
故答案为:c;
(6)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气,
故答案为:D中黑色粉末变红,E中白色粉末变蓝.
点评 本题综合考查元素化合物知识,考查性质实验方案设计,熟悉相关物质的性质是解题关键,注意二价铁离子、三价铁离子的检验方法,题目难度中等.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
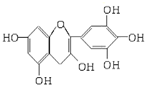 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )| A. | ②④ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H与D,16O与18O互为同位素,H216O、D216O、H218O、D218O互为同素异形体 | |
| B. | 元素X含氧酸的酸性强于元素Y的含氧酸的酸性,则X的得电子能力强于元素Y | |
| C. | 质量数相同的不同核素,一定属于不同种元素 | |
| D. | HF、HCl、HBr、HI的热稳定性和还原性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明KSP(AgCl)>KSP(AgI) | |
| B. | Na2CO3溶液滴入硼酸溶液中,无气泡生成,说明Ka:H2CO3>H3BO3 | |
| C. | 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者 | |
| D. | 若弱酸的酸性H2A>H2B>HA->HB-,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池将化学能转变为电能 | |
| B. | 原电池将电能转变为化学能 | |
| C. | 中和反应放热说明中和反应前后能量不守恒 | |
| D. | 吸热反应中生成物的总能量低于反应物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com